NHS. Lê Thị Mỹ Trinh, BS. Trương Đăng Phúc – Bệnh viện Mỹ Đức
- ĐẶT VẤN ĐỀ
Kích thích buồng trứng (KTBT) trong điều trị thụ tinh trong ống nghiệm (TTTON) là việc sử dụng thuốc để tạo nên sự phát triển của nhiều nang noãn trên buồng trứng. KTBT có vai trò quan trọng trong việc tối đa hoá số lượng noãn trưởng thành thu được, từ đó làm tăng tỷ lệ tạo phôi và cơ hội có thai cho người bệnh. Tuy nhiên, tỷ lệ bệnh nhân có đáp ứng buồng trứng kém (Poor Ovarian Response – POR) ước tính chiếm từ 9% đến 24% các trường hợp KTBT 1, là một thách thức lớn trong việc tối ưu hoá tỷ lệ có thai tích luỹ vì số noãn thu được thấp, dẫn đến số lượng phôi ít hơn. Trước đây định nghĩa POR chưa nhận được sự thống nhất rộng rãi. Để giải quyết vấn đề này và cải thiện kết quả điều trị ở nhóm bệnh nhân tiên lượng đáp ứng kém buồng trứng, phân loại POSEIDON đã được giới thiệu vào năm 2016 với mục tiêu cải thiện tỷ lệ thai ở nhóm bệnh nhân có tiên lượng kém, thay vì chỉ tập trung vào đáp ứng buồng trứng và số lượng noãn thu được. Phân loại POSEIDON chia làm 4 nhóm dựa theo các tiêu chí: tuổi của bệnh nhân, dự trữ buồng trứng, bao gồm số nang noãn thứ cấp (Antral Follicle Count – AFC) hay nồng độ Anti-Müllerian Hormone (AMH), đáp ứng buồng trứng trong các chu kỳ chọc hút trước đó2. Nhiều phương pháp điều trị đã được đề xuất nhằm khắc phục tình trạng buồng trứng đáp ứng kém, trong đó một số nghiên cứu cho thấy việc bổ sung androgen trước khi kích thích buồng trứng có thể giúp cải thiện số lượng noãn thu được ở nhóm bệnh nhân đáp ứng buồng trứng kém3–5. Vì thế, việc làm rõ vai trò và mối liên hệ giữa androgen với đáp ứng buồng trứng là cần thiết, góp phần định hướng các chiến lược can thiệp hiệu quả hơn nhằm cải thiện kết quả điều trị cho người bệnh.
- TỔNG QUAN VỀ LÝ THUYẾT
Phân loại androgen và thụ thể androgen (AR)
Androgen là nhóm nội tiết tố sinh dục có vai trò quan trọng trong quá trình sinh tổng hợp nội tiết sinh dục và điều hoà chức năng sinh sản. Về mặt sinh hoá, các loại androgen chính được chia thành các phân nhóm theo thứ tự hoạt tính tăng dần, bao gồm: dehydroepiandrosterone sulfat (DHEA-S), dehydroepiandrosterone (DHEA), androstenedione, testosterone và dihydrotestosterone (DHT). Ở dạng tiền chất, các androgen như DHEA-S, DHEA, và androstenedione được xem là các androgen yếu cần phải được cơ thể chuyển đổi thành các dạng hoạt tính mạnh hơn để phát huy hết tác dụng sinh học. Chỉ có testosterone và DHT là dạng có hoạt tính sinh học và có khả năng gắn trực tiếp với thụ thể androgen (androgen receptor-AR). Sự hoạt động và phát triển của AR có vai trò thiết yếu trong suốt quá trình phát triển nang noãn từ giai đoạn nang noãn nguyên thủy đến khi trưởng thành. AR không chỉ là mục tiêu gắn kết của các androgen mà còn tham gia vào mạng lưới tương tác với các nội tiết tố khác như nội tiết tố kích thích nang noãn (Follicle Stimulating Hormone-FSH), có vai trò quan trọng trong quá trình phát triển nang noãn. Tại buồng trứng, AR biểu hiện ở cả tế bào vỏ (theca cells) và tế bào hạt (granulosa cells) của nang noãn phát triển. Một trong những điều đặc biệt phát hiện thấy ở nang noãn giai đoạn sớm là sự xuất hiện của AR trước cả khi có thụ thể FSH (FSH Receptor – FSHR). Nghiên cứu cho thấy androgen có tác động tăng cường biểu hiệu của FSHR ở tế bào hạt và kích thích sự phát triển của nang noãn6. Điều này cho thấy, AR có vai trò trong việc chuẩn bị nang noãn để chúng có thể đáp ứng với FSH ở giai đoạn sau4,7.
Bảng 1: Tác động của các Androgen chính lên buồng trứng4,7
|
Androgen |
Nguồn gốc tổng hợp chủ yếu |
Ái lực với thụ thể Androgen |
Đặc điểm chính |
|
Dehydroepiandrosterone Sulfate (DHEA-S) |
Chủ yếu từ tuyến thượng thận, một phần nhỏ từ mô ngoại vi |
Yếu |
Nồng độ cao nhất nhưng hoạt tính yếu, cần chuyển hoá thành các dạng có hoạt tính |
|
Dehydroepiandrosterone (DHEA) |
Tuyến thượng thận, tế bào vỏ buồng trứng và mô ngoại vi |
Yếu |
Là tiền chất của androstenedione và testosterone, đóng vai trò hỗ trợ nang noãn sơ cấp phát triển |
|
Androstenedione |
Tuyến thượng thận, tế bào vỏ buồng trứng và mô ngoại vi |
Trung bình |
Là tiền chất của testosterone, tham gia vào quá trình điều hoà sự phát triển nang noãn, tăng cao trong PCOS |
|
Testosterone |
Tuyến thượng thận, tế bào vỏ buồng trứng, được tổng hợp từ Androstenedione |
Mạnh |
Có thể chuyển thành estrogen, thúc đẩy sự phát triển nang và tăng biểu hiện của yếu tố tăng trưởng giống Insulin loại 1 (Insulin-like Growth Factor 1 - IGF-1) |
|
Dihydrotestosterone (DHT) |
Tổng hợp ở mô ngoại vi (da, gan, cơ quan sinh dục, buồng trứng) từ testosterone |
Rất mạnh (gấp 2 lần testosterone) |
Không thể chuyển thành estrogen, giúp điều chỉnh stress tế bào và apoptosis |
Androgen tác động lên buồng trứng qua hai con đường trực tiếp và gián tiếp (Hình 1). Các androgen có hoạt tính sinh học cao như DHT và testosterone sẽ gắn trực tiếp vào AR và tác động lên quá trình phát triển nang noãn. Bên cạnh tác động trực tiếp lên thụ thể androgen, androgen còn được sử dụng làm nguyên liệu để tổng hợp estradiol. Hai cơ chế này cho thấy, androgen không đơn thuần là hormone hoạt động đơn lẻ mà còn là thành tố quan trọng để tạo nên một mạng lưới phức tạp điều hoà chức năng buồng trứng.
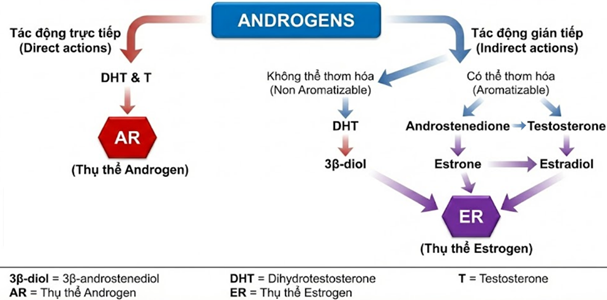
Hình 1: Các cơ chế tác động qua trung gian thụ thể androgen và thụ thể estrogen
Vai trò của androgen trong phát triển nang noãn
Tại buồng trứng, androgen đóng vai trò là tiền chất thiết yếu cho sự tổng hợp estradiol trong quá trình phát triển của nang noãn. Theo mô hình “hai tế bào – hai gonadotropin”, các tế bào vỏ buồng trứng dưới tác động của nội tiết tố hoàng thể hóa (Luteinizing hormone -LH) tổng hợp androgen (chủ yếu là androstenedione và testosterone), sau đó khuếch tán sang tế bào hạt, nơi chúng được chuyển hoá thành estradiol thông qua men thơm hóa (aromatase) dưới sự điều hoà của FSH 8.
Ngoài vai trò là nguyên liệu tổng hợp estradiol, androgen còn có tác động trực tiếp đến sự phát triển nang noãn thông qua AR6. Thụ thể androgen biến thiên rõ rệt nhất ở tế bào hạt và tế bào vỏ của nang noãn giữa các giai đoạn của nang noãn, AR biểu hiện nhiều nhất ở tế bào hạt của nang tiền hốc và nang có hốc nhỏ, giúp tăng biểu hiện FSHR trên tế bào hạt, qua đó làm tăng độ nhạy cảm với FSH và thúc đẩy quá trình chiêu mộ và phát triển nang noãn giai đoạn sớm. Tuy nhiên, tác dụng của androgen thay đổi phụ thuộc vào nồng độ và giai đoạn phát triển của nang noãn. Ở nồng độ sinh lý và ở giai đoạn sớm phát triển nang noãn, AR được tìm thấy xuất hiện sớm hơn cả FSHR. Sự biểu hiện của AR trong nang noãn tiền hốc cho thấy androgen đóng một vai trò quan trọng trong việc chuẩn bị nang noãn cho sự chiêu mộ và đáp ứng với FSH ở giai đoạn sau. Ngược lại, ở nồng độ cao hoặc phơi nhiễm kéo dài với androgen như Hội chứng buồng trứng đa nang (Polycystic Ovary Syndrome - PCOS), androgen có thể ức chế hoạt động men thơm hóa (aromatase), làm giảm tổng hợp estradiol, đồng thời tăng biểu hiện các tín hiệu chết chương trình (apoptosis) trong tế bào hạt, dẫn đến ức chế phát triển nang noãn 9. Tương tự, trong giai đoạn muộn của quá trình phát triển nang noãn, nồng độ cao androgen ức chế sự phát triển của nang và sản xuất estradiol. Cơ chế này giải thích hiện tượng androgen vừa có thể thúc đẩy phát triển nang ở giai đoạn sớm vừa ức chế phát triển ở giai đoạn muộn7.
Để tìm hiểu tầm quan trọng của AR trong sinh lý buồng trứng, các nhà khoa học đã tổng hợp những thông tin từ mô hình chuột bị loại bỏ hoàn toàn thụ thể androgen (Androgen Receptor Knockout – ARKO) 4,7. Các androgen tác động lên thụ thể AR theo nguyên tắc “chìa khóa-ổ khóa”, tương tự với các nội tiết khác trong cơ thể, kích hoạt một chuỗi phản ứng nội bào dẫn đến thay đổi chức năng tế bào và điều hòa các chức năng của cơ thể. Bằng cách loại bỏ AR, các nhà khoa học có thể quan sát chính xác điều gì xảy ra khi cơ thể thiếu androgen. Trong mô hình bất hoạt gen thụ thể androgen toàn bộ (global ARKO), AR bị bất hoạt ở tất cả các tế bào trong cơ thể dẫn đến một loạt các bất thường khi thiếu vắng tín hiệu của androgen bao gồm buồng trứng, hệ thống thần kinh nội tiết, tử cung, các mô và tế bào ngoài buồng trứng khác. Kết quả là chuột cái ARKO toàn bộ biểu hiện các bất thường trong phát triển tử cung, đồng thời cũng có những đặc điểm tương tự PCOS như đề kháng insulin. Ngoài ra, việc loại bỏ hoàn toàn AR còn ảnh hưởng nghiêm trọng đến sự phát triển nang noãn, dẫn đến số lượng nang tiền hốc ít hơn đáng kể, tỷ lệ chết theo chương trình của tế bào hạt tăng cao, do đó dẫn đến nang noãn thoái hoá sớm và chuột ARKO đáp ứng kém với việc kích thích bằng FSH. Mô hình này đã chứng minh rằng androgen là yếu tố nền tảng, nếu không có tín hiệu androgen qua thụ thể AR, buồng trứng không thể duy trì các nang noãn khoẻ mạnh, không đáp ứng hiệu quả với các kích thích như FSH và cuối cùng là không thể hoàn thành chức năng sinh sản của mình. Tuy nhiên, mô hình ARKO toàn thân không lý giải được những kết quả trên đến từ tác động trực tiếp tại buồng trứng hay do rối loạn tín hiệu từ não bộ và tuyến yên. Để giải quyết vấn đề này, các nhà khoa học đã tạo ra mô hình ARKO đặc hiệu tại tế bào hạt (granulosa cell-specific ARKO) và kết quả cho thấy rằng những con chuột này phát triển kiểu hình buồng trứng giống với mô hình ARKO toàn thân với sự suy giảm về chức năng buồng trứng và khả năng sinh sản như loại bỏ AR toàn thân, trong khi chức năng của androgen ở các mô tế bào khác trong cơ thể vẫn hoạt động. Điều này cho thấy tác động trực tiếp của androgen tại tế bào hạt là yếu tố quan trọng cho sự phát triển nang noãn khoẻ mạnh và đảm bảo chức năng sinh sản của cơ thể 4,7.
- ỨNG DỤNG LÂM SÀNG
Một số bằng chứng lâm sàng đã cho thấy tiềm năng trong việc sử dụng androgen để tối ưu hoá việc kích thích buồng trứng. Các tổng quan hệ thống và phân tích gộp cũng chỉ ra rằng việc bổ sung testosterone có thể làm tăng đáng kể tỷ lệ trẻ sinh sống và tỷ lệ có thai lâm sàng ở bệnh nhân POR4,5,10. Tác giả Neves và cộng sự đã cung cấp những bằng chứng về sự khác biệt trong thực hành lâm sàng của hai loại androgen bao gồm DHEA và testosterone. Theo tác giả Neves và cộng sự (2022), trong khi DHEA không cho thấy hiệu quả rõ rệt trong cải thiện các kết quả điều trị ở nhóm bệnh nhân POR, thì ngược lại testosterone lại cho kết quả đầy hứa hẹn khi tăng số lượng noãn thu được, tỷ lệ thai lâm sàng cao hơn (RR 2,07; 95%, 1,33-3,2) và tỷ lệ trẻ sinh sống cao hơn (RR 2,09; 95%, 1,11-3.95)4. Trái lại, tác giả Fengya Zhu và cộng sự (2023) lại ghi nhận hiệu quả rõ rệt của DHEA trong cải thiện tỷ lệ thai lâm sàng (OR 1.92, 95% CI 1.16-3.16) và tỷ lệ trẻ sinh sống (OR 2.80, 95%CI 1.41-5.57)11. Bên cạnh đó, tác giả Katsika và cộng sự cũng ghi nhận sử dụng testosterone bôi da liều 10-12.5 mg/ngày trước khi KTBT giúp cải thiện đáng kể tỷ lệ trẻ sinh sống (RR 2.07, 95% CI 1.09-3.92; I2=0%, 4 nghiên cứu, 333 phụ nữ) và thai lâm sàng (RR 2.25, 95% CI 1.54-3.30; I2=0%, 8 nghiên cứu, 797 phụ nữ)12. Tác giả Haar và cộng sự gợi ý rằng liệu pháp androgen có thể được cân nhắc sử dụng cho bệnh nhân có tiên lượng đáp ứng kém buồng trứng (POSEIDON phân nhóm 3, 4) giúp cải thiện tỷ lệ trẻ sinh sống, tuy nhiên liều và thời gian sử dụng thuốc trước kích thích buồng trứng cần được nghiên cứu thêm13. Khuyến cáo về các liệu pháp điều trị bổ trợ của Hiệp hội Sinh sản và Phôi học người Châu Âu (ESHRE) không khuyến cáo sử dụng testosterone và DHEA khi kích thích buồng trứng do chưa có các bằng chứng rõ ràng chứng minh hiệu quả14. Các bằng chứng về hiệu quả của liệu pháp androgen vẫn còn hạn chế do sự khác biệt về liều lượng, thời gian sử dụng thuốc, phác đồ KTBT và tiêu chí lựa chọn bệnh nhân giữa các nghiên cứu. Thế nhưng không thể phủ nhận những kết quả ban đầu cho thấy liệu pháp androgen là một lựa chọn tiềm năng để cải thiện kết quả điều trị hỗ trợ sinh sản ở những bệnh nhân có đáp ứng buồng trứng kém. Hiện vẫn cần thêm các thử nghiệm lâm sàng ngẫu nhiên có đối chứng quy mô lớn để xác nhận những phát hiện này và thiết lập một phác đồ điều trị tối ưu.
- KẾT LUẬN
Androgen đóng một vai trò thiết yếu, tác động lên nhiều khía cạnh trong sinh lý buồng trứng và sự phát triển nang noãn, cũng như sức khỏe sinh sản người phụ nữ, vượt xa vai trò chỉ là tiền chất của estrogen. Đặc biệt là vai trò của AR trong việc mồi và khuếch đại đáp ứng của nang noãn với FSH, đã mở ra hướng đi tiềm năng trong việc bổ sung androgen để cải thiện kết quả điều trị cho nhóm bệnh nhân có POR. Các bằng chứng lâm sàng từ các phân tích gộp, cho thấy việc sử dụng testosterone trước chu kỳ kích thích buồng trứng có thể giúp tăng số lượng noãn thu được và cải thiện tỷ lệ có thai lâm sàng cũng như tỷ lệ sinh sống. Tuy nhiên, vẫn cần thêm các dữ liệu từ các thử nghiệm lâm sàng ngẫu nhiên có đối chứng quy mô lớn hơn để tìm ra phác đồ điều trị phù hợp. Việc xác định rõ liều lượng phù hợp, thời gian và đối tượng bệnh nhân phù hợp giúp khai thác tiềm năng của androgen sẽ mang lại kết quả tối ưu hơn cho những cặp vợ chồng hiếm muộn đang đối mặt với thách thức từ POR.