CNSH. Lê Thị Quỳnh – IVFMD SIH – Bệnh viện Phụ sản Quốc tế Sài Gòn
TỔNG QUAN
Sự tiến bộ vượt bậc trong quản lý lâm sàng, đặc biệt là liệu pháp truyền máu định kỳ và các phác đồ thải sắt thế hệ mới, đã biến Thalassemia từ một căn bệnh gây tử vong sớm ở trẻ em thành một rối loạn mạn tính mà bệnh nhân có thể sống tới tuổi trưởng thành và trung niên. Tuy nhiên, sự gia tăng tuổi thọ này cũng bộc lộ những biến chứng muộn phức tạp, trong đó rối loạn nội tiết và suy giảm chức năng sinh sản là những rào cản chính đối với chất lượng cuộc sống. Thalassemia là một nhóm các bệnh lý huyết học di truyền do đột biến hoặc mất đoạn gen điều khiển quá trình tổng hợp chuỗi globin, dẫn đến sự mất cân bằng giữa các chuỗi α và β gây ra tình trạng sinh hồng cầu không hiệu quả, tan máu và thiếu máu mạn tính [1]. Quá tải sắt, hệ quả tất yếu của việc truyền máu kéo dài và sự tăng hấp thu sắt tại ruột, là tác nhân bệnh căn chính gây tổn thương đa cơ quan, đặc biệt là hệ thống sinh sản nữ [2].
Thalassemia là một trong những rối loạn đơn gen phổ biến nhất trên toàn thế giới, với ước tính khoảng 270 triệu người mang gen mạn tính [3]. Bệnh lý này được phân loại dựa trên chuỗi globin bị ảnh hưởng, bao gồm α-Thalassemia (do mất đoạn hoặc đột biến gen α-globin trên nhiễm sắc thể 16) và β-Thalassemia (do đột biến điểm trên cụm gen β-globin trên nhiễm sắc thể 11) [4]. Trong đó, β-Thalassemia thể nặng (Thalassemia Major - TDT) đòi hỏi truyền máu suốt đời để duy trì nồng độ hemoglobin ổn định [5].
Tình trạng quá tải sắt ở bệnh nhân TDT gây ra một loạt các biến chứng nội tiết. Suy tuyến sinh dục là biến chứng phổ biến nhất, ảnh hưởng đến một tỷ lệ lớn bệnh nhân từ độ tuổi dậy thì trở đi. Các nghiên cứu lâm sàng ghi nhận tỷ lệ suy tuyến sinh dục ở bệnh nhân Thalassemia dao động từ 40% đến hơn 90% tùy thuộc vào khu vực địa lý, mức độ kiểm soát sắt và chế độ dinh dưỡng [1]. Nghiên cứu của Taha và cộng sự (2023) trên 80 bệnh nhân Thalassemia thể nặng cho thấy 68,75% gặp phải các rối loạn sinh dục, trong đó phần lớn là suy tuyến sinh dục do giảm gonadotropin (Hypogonadotropic Hypogonadism - HH) [3].
Bên cạnh suy tuyến sinh dục, các bệnh lý nội tiết khác cũng thường xuyên xuất hiện do sự lắng đọng sắt tại các tuyến đích. Đái tháo đường ảnh hưởng đến khoảng 6,3% bệnh nhân, suy giáp (3,8%), và suy tuyến cận giáp (2,5%) [3]. Sự kết hợp của các rối loạn này tạo ra một môi trường nội tiết bất lợi, không chỉ ảnh hưởng đến khả năng có thai mà còn làm tăng nguy cơ sảy thai, thai chậm phát triển và các biến chứng sản khoa khác [3].
CƠ CHẾ BỆNH SINH CỦA QUÁ TẢI SẮT TRONG THALASSEMIA
Sắt là một nguyên tố thiết yếu cho nhiều quá trình sinh học, bao gồm vận chuyển oxy, hô hấp tế bào và tổng hợp DNA [6]. Tuy nhiên, trong Thalassemia, sự điều hòa sắt bị phá vỡ hoàn toàn do hai cơ chế song song: truyền máu ngoại sinh và tăng hấp thu sắt nội sinh [7].
Sự đứt gãy trục Hepcidin-Ferroportin và vai trò của Erythroferrone
Trong điều kiện sinh lý, nồng độ sắt được kiểm soát bởi hepcidin, một hormone peptide do gan sản xuất. Khi hepcidin liên kết với ferroportin - kênh xuất khẩu sắt duy nhất của tế bào nằm trên bề mặt tế bào biểu mô ruột và đại thực bào thì sẽ ngăn chặn sự giải phóng sắt vào hệ tuần hoàn (cơ chế bình thường) [2].
Ở bệnh nhân Thalassemia, tình trạng sinh hồng cầu không hiệu quả gây ra sự giãn nở của tủy xương và sản xuất quá mức hormone erythroferrone từ các nguyên hồng cầu. Erythroferrone trực tiếp ức chế quá trình tổng hợp hepcidin tại gan [2]. Sự sụt giảm hepcidin dẫn đến việc ferroportin hoạt động không kiểm soát, khiến sắt từ chế độ ăn uống được hấp thu tại tá tràng và sắt từ các đại thực bào liên tục được đổ vào máu [8].
Sắt không gắn Transferrin và Sắt huyết tương linh động
Khi lượng sắt đi vào hệ tuần hoàn vượt quá khả năng gắn kết của transferrin (protein vận chuyển sắt chính), các dạng sắt độc hại bắt đầu xuất hiện: sắt không gắn transferrin (Non-Transferrin Bound Iron - NTBI) và dạng hoạt động oxy hóa khử của nó là sắt huyết tương linh động (Labile Plasma Iron - LPI) [2].
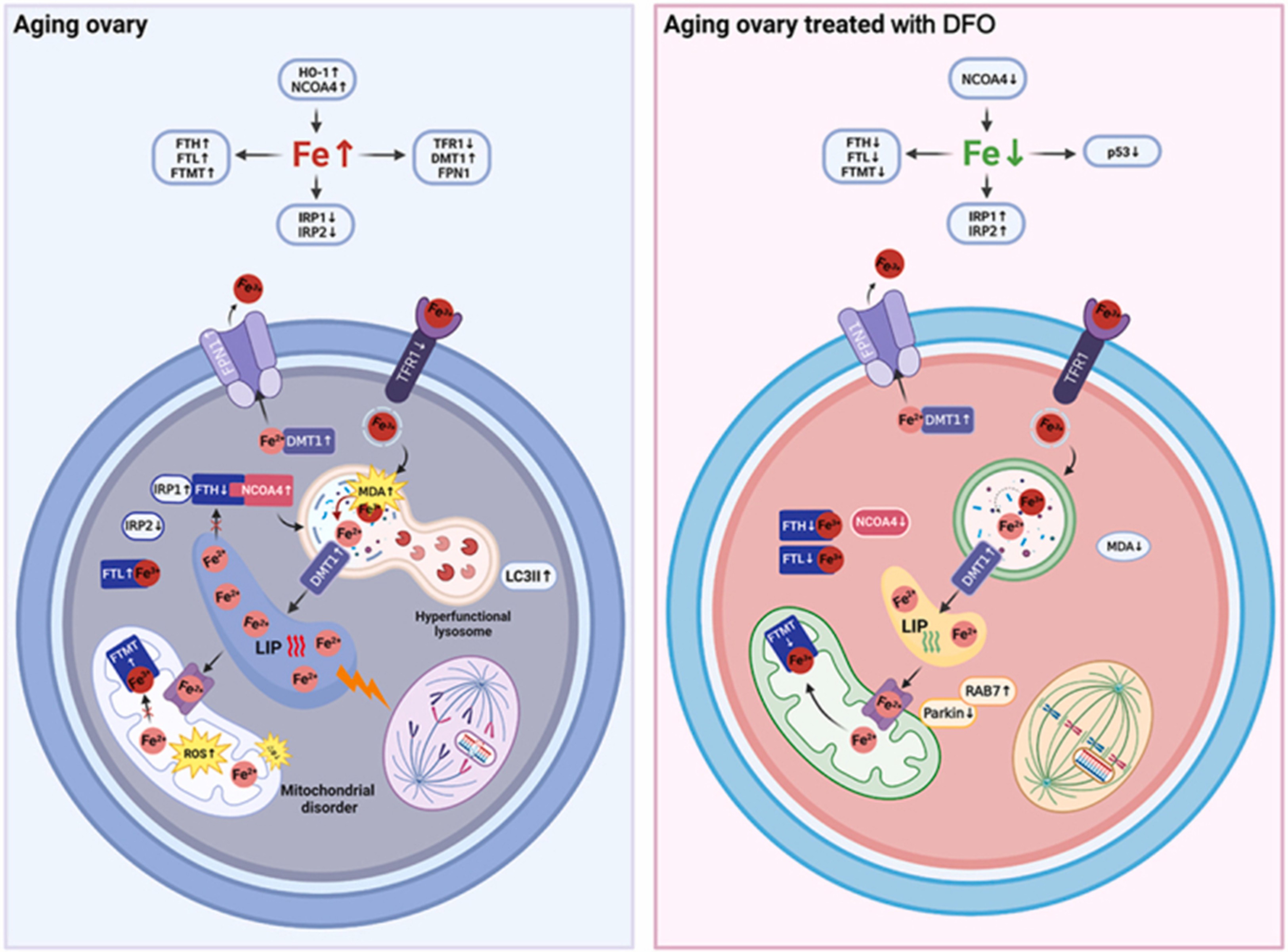
NTBI không được tế bào tiếp nhận qua thụ thể transferrin (TfR1) thông thường. Thay vào đó, nó xâm nhập vào các tế bào nhu mô có hoạt động chuyển hóa cao thông qua các kênh vận chuyển kim loại hóa trị hai không đặc hiệu như DMT1 (Divalent Metal Transporter 1) và ZIP14 [9]. Sự tích tụ NTBI trong tế bào dẫn đến việc hình thành "vũng sắt linh động" (Labile Iron Pool - LIP) trong tế bào chất, nơi sắt sẵn sàng tham gia vào các phản ứng hóa học gây hại [10].
CƠ CHẾ TỔN THƯƠNG TY THỂ DO SẮT VÀ STRESS OXY HOÁ
Sự độc hại của sắt dư thừa trong tế bào chủ yếu thông qua phản ứng Fenton, một quá trình hóa học tạo ra các gốc tự do hoạt động. Trong phản ứng này, sắt hóa trị hai (Fe2+) phản ứng với hydrogen peroxide (H2O2) để tạo ra gốc hydroxyl [11].
Gốc hydroxyl có khả năng oxy hóa hầu hết các phân tử sinh học ngay tại vị trí gốc này được tạo ra. Nó tấn công các axit béo chưa bão hòa trên màng tế bào và màng ty thể, gây ra quá trình peroxy hóa lipid, làm phá hủy tính toàn vẹn của màng và tạo ra các aldehyde độc hại như malondialdehyde (MDA) và 4-hydroxynonenal (4-HNE) [11].
Vai trò của protein ZNF185 và động lực học của ty thể trong tế bào hạt
Ty thể là cơ quan trung tâm của quá trình chuyển hóa năng lượng và cũng là nơi chứa nồng độ sắt cao nhất để tổng hợp các cụm sắt-lưu huỳnh (Fe-S) và nhân heme. Tuy nhiên, khi sắt tích tụ quá mức trong ty thể, nó gây ra các biến đổi siêu cấu trúc nghiêm trọng [12].
Nghiên cứu cơ chế phân tử gần đây của Huang và cộng sự (2025) đã làm sáng tỏ vai trò của Zinc Finger Protein 185 (ZNF185) trong việc trung gian tổn thương buồng trứng do sắt. ZNF185 là một protein liên kết với khung xương tế bào actin. Dưới tác động của quá tải sắt, biểu hiện của ZNF185 trong các tế bào hạt buồng trứng (Granulosa Cells - GCs) tăng lên phụ thuộc vào liều lượng [13].
Sự hiện diện quá mức của ZNF185 dẫn đến việc tái cấu trúc các sợi actin (F-actin), làm xáo trộn cấu trúc ổn định của khung xương tế bào. Sự thay đổi này kích hoạt việc chiêu mộ protein liên quan đến dynamin 1 (Drp1) từ tế bào chất đến màng ngoài ty thể. Drp1 hoạt động như một "kéo phân tử", thắt chặt và phân chia ty thể, dẫn đến tình trạng phân mảnh ty thể quá mức [13].
Sự phân mảnh ty thể làm giảm hiệu quả của chuỗi vận chuyển điện tử và gia tăng sản sinh ROS. Khi nồng độ ROS vượt quá khả năng chống oxy hóa của tế bào, nó dẫn đến việc giải phóng cytochromeC vào tế bào chất [13]. Sự kiện này kích hoạt phức hợp Caspase-9/Caspase-3, dẫn đến quá trình apoptosis (chết tế bào theo chương trình) của tế bào hạt [14]. Vì tế bào hạt đóng vai trò thiết yếu trong việc nuôi dưỡng noãn và sản xuất hormone steroid, sự thiếu hụt này trực tiếp dẫn đến thoái hóa nang noãn và suy giảm dự trữ buồng trứng.
ĐÁNH GIÁ CHỨC NĂNG BUỒNG TRỨNG Ở BỆNH NHÂN THALASSEMIA
Việc đánh giá chính xác dự trữ buồng trứng là rất quan trọng để quản lý sức khỏe sinh sản và tư vấn bảo tồn khả năng sinh sản cho bệnh nhân Thalassemia. Tuy nhiên, tình trạng suy tuyến sinh dục do giảm gonadotropin phổ biến ở nhóm bệnh nhân này làm cho các xét nghiệm truyền thống trở nên kém tin cậy.
Hormone Anti-Müllerian (AMH)
AMH được sản xuất bởi các tế bào hạt của nang noãn tiền hốc và nang hốc nhỏ, phản ánh trực tiếp số lượng nang moãn nguyên thủy còn lại trong buồng trứng. Điều quan trọng là AMH không phụ thuộc vào sự điều hòa của gonadotropin tuyến yên và nồng độ của nó tương đối ổn định trong suốt chu kỳ kinh nguyệt [15].
Các nghiên cứu chỉ ra rằng: (1) Nồng độ AMH ở nữ giới Thalassemia thấp hơn đáng kể so với người khỏe mạnh cùng độ tuổi. (2) AMH có mối tương quan nghịch rõ rệt với nồng độ Ferritin huyết thanh và nồng độ sắt không gắn transferrin. (3) Ở bệnh nhân Thalassemia thể trung gian, mặc dù không truyền máu thường xuyên, AMH vẫn bắt đầu giảm mạnh sau tuổi 25, sớm hơn khoảng 5-10 năm so với quần thể chung [15].
Sự sụt giảm AMH sau tuổi 25 ở bệnh nhân Thalassemia thể trung gian được giải thích là do sự tích tụ sắt dần dần qua đường ruột theo thời gian, kết hợp với tình trạng tan máu mạn tính gây stress oxy hóa kéo dài [15]. Điều này nhấn mạnh tầm quan trọng của việc theo dõi AMH định kỳ ngay cả ở những bệnh nhân không phụ thuộc truyền máu.
BẢO TỒN KHẢ NĂNG SINH SẢN
Tối ưu hóa thải sắt và kiểm soát sắt nội bào
Việc duy trì nồng độ ferritin huyết thanh dưới 1000 ng/ml và kiểm soát nồng độ LPI là mục tiêu hàng đầu. Các chất thải sắt như Deferoxamine có khả năng giảm điện thế oxy hóa của sắt huyết thanh, trong khi các tác nhân đường uống như Deferiprone và Deferasirox có thể thâm nhập vào các mô tốt hơn để loại bỏ sắt nội bào [4]. Sự tuân thủ thải sắt nghiêm ngặt đã được chứng minh là cải thiện nồng độ AMH và tăng khả năng phục hồi chức năng trục tuyến yên ở một số bệnh nhân.
Liệu pháp chống oxy hóa: N-acetylcysteine và MitoQ
Vì stress oxy hóa là trung gian của cả tổn thương ty thể và xơ hóa, việc sử dụng các chất chống oxy hóa đã cho thấy những kết quả hứa hẹn.
- N-acetylcysteine (NAC): Là tiền chất của glutathione, NAC giúp tăng cường hệ thống phòng thủ chống oxy hóa nội sinh. Các thử nghiệm lâm sàng trên bệnh nhân Thalassemia cho thấy bổ sung NAC (liều khoảng 600 mg/ngày) làm giảm các dấu hiệu peroxy hóa lipid và cải thiện tình trạng oxy hóa tổng thể [16].
- MitoQ (Mitoquinol mesylate): Đây là một chất chống oxy hóa nhắm mục tiêu ty thể, được cấu tạo từ một phân tử ubiquinone gắn với cation triphenylphosphonium (TPP+). Cấu trúc này cho phép MitoQ tích tụ trong ty thể cao gấp hàng trăm lần so với các chất chống oxy hóa thông thường. MitoQ đã được chứng minh là có khả năng giảm phân mảnh ty thể, bảo vệ điện thế màng và ngăn chặn quá trình xơ hóa do ROS gây ra trong các mô hình bệnh lý tương tự [17].
Trữ lạnh mô buồng trứng và Ghép mô buồng trứng
Đối với những bé gái mắc Thalassemia thể nặng phải chuẩn bị cho ghép tế bào gốc tạo máu, trữ lạnh mô buồng trứng là lựa chọn bảo tồn khả năng sinh sản duy nhất khả thi trước tuổi dậy thì. Ghép tế bào gốc tạo máu đòi hỏi các phác đồ hóa trị liệu liều cao có độc tính sinh dục cực kỳ nghiêm trọng, dẫn đến suy buồng trứng sớm ở hơn 90% bệnh nhân [18].
Kỹ thuật trữ lạnh mô buồng trứng bao gồm việc lấy một phần vỏ buồng trứng chứa các nang noãn nguyên thủy thông qua phẫu thuật nội soi. Sau đó, mô được cắt thành các mảnh nhỏ và trữ đông bằng phương pháp hạ nhiệt độ chậm hoặc thủy tinh hóa. Sau khi bệnh nhân khỏi bệnh và trưởng thành, mô có thể được ghép trở lại để khôi phục chức năng nội tiết và khả năng sinh sản tự nhiên [18].
Dữ liệu lâm sàng cho thấy:
- Mật độ nang noãn ở các bé gái Thalassemia trước khi ghép tế bào gốc thường nằm trong giới hạn bình thường so với tuổi, cho thấy quá tải sắt ở trẻ em chưa gây ra sự mất nang noãn hoàn toàn [19].
- Tỷ lệ sinh con sống sau khi ghép lại mô buồng trứng trữ lạnh đạt khoảng 26% đến 57% [18].
- Chức năng nội tiết (sản xuất estrogen) thường được khôi phục sau 3-4 tháng sau khi ghép mô [18].
Tuy nhiên, một thách thức lớn đối với trữ lạnh mô buồng trứng ở bệnh nhân Thalassemia là tình trạng viêm và xơ hóa buồng trứng có sẵn do sắt có thể làm giảm khả năng sống sót của mô sau khi rã đông và ghép lại. Do đó, việc thải sắt tối ưu trước khi thực hiện trữ lạnh mô buồng trứng là một khuyến cáo quan trọng.
KẾT LUẬN
Tổn thương chức năng buồng trứng ở bệnh nhân Thalassemia là kết quả của một quá trình bệnh lý phức tạp và kéo dài, bắt đầu từ sự lắng đọng sắt tại tuyến yên gây HH và tiến triển đến tổn thương nhu mô buồng trứng trực tiếp qua con đường ty thể và xơ hóa. Sự phát hiện ra trục ZNF185-Drp1 và con đường xơ hóa TGF-β đã cung cấp những mục tiêu phân tử mới cho các liệu pháp can thiệp.
Trong thực hành lâm sàng, việc sử dụng AMH như một dấu hiệu sinh học để theo dõi dự trữ buồng trứng nên được thực hiện định kỳ cho tất cả nữ giới mắc Thalassemia từ giai đoạn thanh thiếu niên. Đối với những bệnh nhân chuẩn bị ghép tế bào gốc, trữ lạnh mô buồng trứng nên được coi là một phần không thể thiếu của quy trình điều trị để đảm bảo quyền lợi sinh sản và chất lượng cuộc sống trong tương lai. Những nghiên cứu sâu hơn về cơ chế biểu di truyền và sự tương tác giữa sắt với hệ vi sinh vật buồng trứng hứa hẹn sẽ mang lại những đột phá mới trong việc cá nhân hóa điều trị cho bệnh nhân Thalassemia.
Từ khoá: thalassemia, trữ lạnh mô buồng trứng, khả năng sinh sản, AMH, liệu pháp chống oxy hoá.
Tài liệu tham khảo:
[1] Tsilionis et al. (2024). Reproductive health in women with major β-thalassemia: evaluating ovarian reserve and endocrine complications. Metabolites, 14(12), 717.
[2] Taher et al. (2017). Iron overload in thalassemia: different organs at different rates. Hematology 2014, the American Society of Hematology Education Program Book, 2017(1), 265-271.
[3] Mahwi et al. (2023). Hypogonadism among patients with transfusion-dependent thalassemia: a cross-sectional study. Annals of Medicine and Surgery, 85(7), 3418-3422.
[4] Bajwa, H., & Basit, H. (2019). Thalassemia.
[5] Ibrahim et al. (2021). Impact of male infertility on semen parameters and reproductive hormones. International Journal of Blood Research and Disorders, 8(1), 066. https://doi.org/10.23937/2469-5696/1410066
[6] Rockfield et al. (2017). Iron overload and altered iron metabolism in ovarian cancer. Biological chemistry, 398(9), 995-1007.
[7] Mariani et al. (2009). Iron metabolism in thalassemia and sickle cell disease. Mediterranean journal of hematology and infectious diseases, 1(1), e2009006.
[8] Ginzburg, Y., & Rivella, S. (2011). β-thalassemia: a model for elucidating the dynamic regulation of ineffective erythropoiesis and iron metabolism. Blood, The Journal of the American Society of Hematology, 118(16), 4321-4330.
[9] Coffey et al. (2017). The plasma membrane metal-ion transporter ZIP14 contributes to nontransferrin-bound iron uptake by human β-cells. American Journal of Physiology-Cell Physiology, 312(2), C169-C175.
[10] Liu et al. (2024). Redox-regulated iron metabolism and ferroptosis in ovarian cancer: molecular insights and therapeutic opportunities. Antioxidants, 13(7), 791.
[11] Chen et al. (2024). Iron accumulation in ovarian microenvironment damages the local redox balance and oocyte quality in aging mice. Redox Biology, 73, 103195.
[12] Rouault, T. A. (2016). Mitochondrial iron overload: causes and consequences. Current opinion in genetics & development, 38, 31-37.
[13] Huang et al. (2025). Iron-responsive ZNF185 overexpression drives mitochondrial fission and endoplasmic reticulum stress via cytoskeletal remodeling in granulosa cells. Cell Death Discovery, 11(1), 414.
[14] Li et al. (2025). Fundamental mechanisms of cell death for polycystic ovary syndrome. Biochemistry and Biophysics Reports, 43, 102043.
[15] Li et al. (2025). Anti-mullerian hormone evaluates ovarian function in patients with non-transfusion-dependent thalassemia. Mediterranean Journal of Hematology and Infectious Diseases, 17(1), Article e2025007. https://doi.org/10.4084/MJHID.2025.007
[16] Ghazaiean et al. (2024). Antioxidative effects of N‐acetylcysteine in patients with β–thalassemia: A quick review on clinical trials. Health Science Reports, 7(10), e70096.
[17] Abdeahad et al. (2025). MitoQ reduces senescence burden in Doxorubicin-treated endothelial cells by reducing mitochondrial ROS and DNA damage. American Journal of Physiology-Heart and Circulatory Physiology, 329(5), H1154-H1161.
[18] Diaz et al. (2022). A systematic review of ovarian tissue transplantation outcomes by ovarian tissue processing size for cryopreservation. Frontiers in endocrinology, 13, 918899.
[19] Mamsen et al. (2021). Consequences of β-Thalassemia or Sickle Cell Disease for Ovarian Follicle Number and Morphology in Girls Who Had Ovarian Tissue Cryopreserved. Frontiers in endocrinology, 11, 593718. https://doi.org/10.3389/fendo.2020.593718