CNSH. Nguyễn Hữu Thịnh, CNSH. Nguyễn Thị Minh Phượng – Bệnh viện Mỹ Đức
-
I. Đặt vấn đề
Vô sinh là một vấn đề sức khỏe gây ra những hậu quả về thể chất và tâm lý ảnh hưởng đến khả năng sinh sản của các cặp vợ chồng. Đây là một tình trạng được công nhận rộng rãi ảnh hưởng đến 10–15% các cặp vợ chồng trên toàn thế giới, với khoảng 50% trường hợp liên quan đến yếu tố nam giới hoặc kết hợp với yếu tố nữ giới [1]. Những nghiên cứu gần đây đã chứng minh các bất thường về số lượng, khả năng vận động và hình dạng tinh trùng đều có liên quan trực tiếp đến vô sinh nam. Khả năng vận động của tinh trùng rất cần thiết cho quá trình thụ tinh với khoảng 80% trường hợp vô sinh do khả năng di động bị suy giảm [2]. Sự phối hợp nhịp nhàng của các thành phần cấu trúc tạo nên lực đẩy ở đuôi tinh trùng quyết định khả năng di chuyển trong đường sinh dục nữ. Khi quá trình vận động rối loạn do bất thường chức năng, tổn thương cấu trúc bên trong đuôi hay rối loạn cơ chế tạo lực đẩy đều khiến tinh trùng không thể di chuyển dẫn đến giảm đáng kể khả năng sinh sản ở nam giới. Trong các nhóm bất thường về vận động ở đuôi, đa bất thường hình thái đuôi tinh trùng (Multiple Morphological Abnormalities of the Flagella – MMAF) được biết đến như một kiểu hình đặc biệt nghiêm trọng, một trong những nguyên nhân gây vô sinh ở nam giới [3]. Bài viết này cung cấp cái nhìn tổng quan về đa bất thường hình thái đuôi tinh trùng, đồng thời tổng hợp một số bằng chứng lâm sàng hiện có về những phương pháp hỗ trợ sinh sản áp dụng cho bệnh nhân MMAF nhằm cung cấp cơ sở khoa học cho chẩn đoán và chiến lược trong điều trị.
-
II. Đa bất thường hình thái đuôi tinh trùng
Khái niệm đa bất thường hình thái đuôi tinh trùng (MMAF) được đề xuất lần đầu tiên vào năm 2014 với báo cáo đầu tiên cách đây hơn 40 năm. Tình trạng này được đặc trưng bởi kiểu hình bất thường ở phần đuôi như không có đuôi, đuôi ngắn, đuôi cong, đuôi cuộn hoặc đuôi không đều, phản ánh sự tổn thương các thành phần siêu cấu trúc bên trong đuôi tinh trùng [3].
Hoạt động của đuôi tinh trùng phụ thuộc vào sự phối hợp của các thành phần cấu trúc như sợi trục, cánh tay dynein, cặp vi ống trung tâm, phức hợp điều hòa Nexin-Dynein và các nan hoa hướng tâm (Hình 1). Bất kỳ những bất thường nào làm ảnh hưởng đến chức năng của các cấu trúc này đều có thể làm suy giảm khả năng di chuyển của tinh trùng. Nguyên nhân dẫn đến tình trạng MMAF chủ yếu bắt nguồn từ các đột biến gen xảy ra trong quá trình sinh tinh. Đến nay, đã có hơn 40 gen liên quan đến cơ chế gây bệnh MMAF được báo cáo, chiếm khoảng 30-60% tổng số bệnh nhân mắc MMAF được ghi nhận [3, 4].
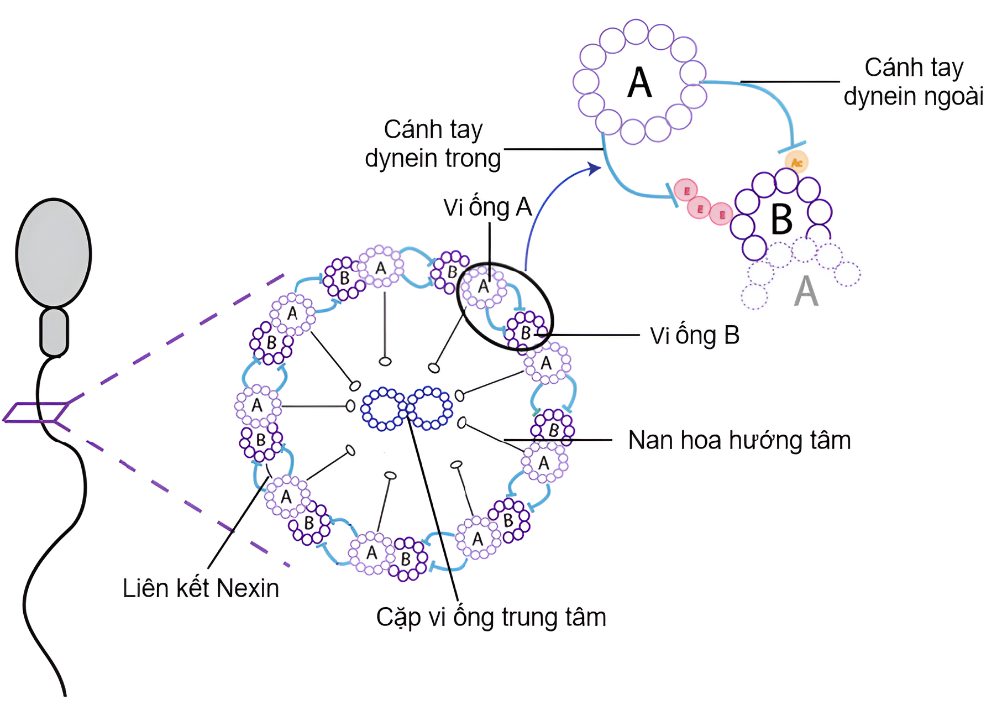
Hình 1: Cấu trúc bên trong của đuôi tinh trùng [5].
-
Bất thường cấu trúc sợi trục
Sợi trục phụ thuộc vào sự toàn vẹn của các thành phần cấu tạo và tương tác có tổ chức giữa chúng để duy trì tính ổn định của toàn bộ đuôi tinh trùng [4]. Với vai trò lõi trung tâm, sợi trục đặc biệt quan trọng trong cấu trúc và chức năng của đuôi tinh trùng nên bất kỳ bất thường trong các thành phần của sợi trục đều có thể dẫn đến rối loạn hình thái đuôi.
Bất thường trong cánh tay dynein
Cánh tay dynein duy trì tần số và dạng sóng đặc trưng của đuôi tinh trùng với các đột biến gen mã hóa cấu trúc này được ghi nhận là nguyên nhân gây ra MMAF. Các cánh tay dynein bên trong và cánh tay dynein bên ngoài đóng vai trò như “động cơ” điều hòa hoạt động nhịp nhàng của đuôi và không thể thiếu cho khả năng di chuyển của tinh trùng [4]. DNAH1 là một gen thuộc nhóm cánh tay dynein bên trong và được phát hiện có tần suất đột biến cao nhất trong các trường hợp MMAF. Theo nghiên cứu của Wang và cộng sự (2020) cho thấy khả năng di động tiến tới của tinh trùng mang đột biến DNAH1 tương đối cao so với các nguyên nhân di truyền khác gây nên bất thường cấu trúc sợi trục, dao động từ 0% đến 13% [6]. DNAH1 khi đột biến làm cấu trúc “9+2” mất cân bằng thông qua việc loại bỏ thành phần trong vị trí neo của nan hoa hướng tâm dẫn đến sự liên kết kém ổn định của cặp vi ống trung tâm. Cấu trúc điển hình của sợi trục bao gồm một cặp vi ống trung tâm được bao quanh bởi chín cặp vi ống ngoại vi tạo nên cấu trúc “9+2”. Chính sự đột biến phá vỡ cấu trúc “9+2” và rối loạn quá trình sinh tổng hợp sợi trục do đột biến DNAH1 chính là nguyên nhân gây ra hiện tượng MMAF [7].
Bất thường trong cặp vi ống trung tâm
Các đột biến của hai gen CFAP43 và CFAP44 đã được chứng minh có ảnh hưởng trực tiếp đến cấu trúc của cặp vi ống trung tâm, gây rối loạn tổ chức sợi trục ở đuôi tinh trùng và làm mất khả năng tạo sóng uốn nhịp nhàng [6]. Hai gen này nằm cạnh cầu nối 5–6 của cặp vi ống ngoại vi nhằm hạn chế sự trượt giữa các cặp vi ống so với bộ phận bên cạnh, chúng đóng vai trò quan trọng trong hoạt động di chuyển của đuôi tinh trùng [8]. Nghiên cứu của Coutton và cộng sự (2018) cho thấy tỉ lệ cấu trúc “9+0” ở bệnh nhân đột biến gen CFAP43 cao hơn ở CFAP44 gây ảnh hưởng nghiêm trọng đến khả năng di động của tinh trùng [8].
Bất thường trong nan hoa hướng tâm
Adenylate kinase 7 (AK7) là một gen khác có liên quan đến MMAF. AK7 rất cần thiết để duy trì sự cân bằng của các nhóm nucleotide adenosine gồm ADP, ATP và AMP thông qua quá trình phosphoryl hóa chuyển đổi hai phân tử ADP thành một phân tử ATP và AMP, giúp cung cấp nguồn năng lượng liên tục cho quá trình lắp ráp và di chuyển của đuôi tinh trùng [9]. Khi AK7 đột biến dẫn đến quá trình tổng hợp ATP bị suy giảm, nguồn năng lượng cung cấp cho hoạt động của các cánh tay dynein bị mất đi và làm đuôi tinh trùng giảm dao động mạnh.
Bất thường trong phức hợp Nexin-Dynein
Trên phức hợp Nexin–Dynein (N-DRC), gen DRC1 đóng vai trò như cầu nối giữa các cặp vi ống ngoại vi, giúp ổn định cấu trúc “9+2” và phối hợp hoạt động với cánh tay dynein để tạo ra chuyển động đuôi tinh trùng. Đột biến gen DRC1 làm rối loạn cơ chế trượt của cánh tay dynein. Với đột biến này, cấu trúc “9+2” vẫn được giữ nguyên nhưng liên kết giữa các cặp vi ống ngoại vi không còn, làm suy giảm khả năng vận động của tinh trùng [10]. Những tổn thương liên quan đến sự thiếu hụt DRC1 ở tinh trùng biểu hiện rõ rệt bằng các rối loạn cấu trúc sợi trục.
-
Bất thường cấu trúc bao quanh sợi trục
Cấu trúc bao quanh sợi trục là lớp bao sợi ở bên ngoài. Các protein neo A-kinase như AKAP3 và AKAP4 là các thành phần chính của bao sợi. Khi đột biến, đuôi tinh trùng thường thiếu hoặc mất các thành phần của cặp vi ống trung tâm và cánh tay dynein, dẫn đến kiểu hình đuôi ngắn, dày và di động kém [11]. Bên cạnh đó, cấu trúc này còn bị ảnh hưởng bởi gen FSIP2 đóng vai trò trong việc neo giữ và ổn định gen AKAP4 giúp đảm bảo quá trình lắp ráp và ổn định cấu trúc bao sợi [12]. Khi FSIP2 đột biến khiến cho liên kết của AKAP4 bị phá vỡ khiến quá trình lắp ráp bao sợi sai lệch, từ đó hình thành một dạng đặc biệt của MMAF là loạn sản bao sợi (Dysplasia of the fibrous sheath - DFS). DFS được Chemes và cộng sự giới thiệu vào năm 1987 nhằm mô tả các bất thường của sợi trục và các cấu trúc bao quanh sợi trục của tinh trùng [13]. Đặc điểm của nhóm này là sự tăng sản và phì đại bao sợi dẫn đến làm giảm hoặc mất hoàn toàn khả năng di động tinh trùng gây nên tình trạng vô sinh ở nam giới [14, 15].
-
Bất thường trong hệ thống vận chuyển protein
Giai đoạn cuối cùng trong quá trình sinh tinh là kéo dài đuôi tinh trùng nhờ vào hoạt động vận chuyển protein diễn ra mạnh mẽ. Nổi bật là hệ thống vận chuyển bên trong đuôi (Intra-Flagellar Transport - IFT), đây là quá trình hai chiều với phức hợp IFT-A và IFT-B mà qua đó các phân tử được vận chuyển liên tục từ đầu đến đuôi và ngược lại [6]. IFT giúp di chuyển protein dọc theo vi ống của sợi trục trong quá trình hình thành và duy trì đuôi tinh trùng. Gen CFAP69 có vai trò liên kết, điều hòa hoạt động quá trình lắp ráp, ổn định đuôi của tinh trùng và sự hình thành của các vi ống cặp trung tâm. CFAP69 tương tác với một số yếu tố tham gia vào quá trình tạo thành đầu tinh trùng và lắp ráp cặp vi ống trung tâm thông qua con đường IFT trong quá trình sinh tinh [6]. Đột biến gen làm quá trình vận chuyển không đúng vị trí dẫn đến các thành phần sợi trục và bao quanh sợi trục không được sắp xếp, đồng thời ảnh hưởng nghiêm trọng đến sự hình thành đuôi của tinh trùng [16].
-
Xét nghiệm tinh dịch đồ
Xét nghiệm tinh dịch đồ là xét nghiệm đầu tay khi nam giới muốn đánh giá khả năng sinh sản. Với những trường hợp nghi ngờ thuộc nhóm MMAF, kết quả được đặc trưng bởi tình trạng tinh trùng có đuôi bất thường về hình thái như không có đuôi, đuôi ngắn, đuôi cong, đuôi cuộn hoặc đuôi không đều và đặc biệt khả năng di động rất thấp hoặc bất động hoàn toàn. Những thông tin trên vẫn chưa có thể kết luận chắc chắn nam giới thuộc nhóm MMAF, do đó cần thực hiện thêm các phương pháp chẩn đoán chuyên sâu và chính xác hơn trong giai đoạn điều trị sau này [4].
-
Đánh giá siêu cấu trúc
Kính hiển vi điện tử truyền qua (Transmission Electron Microscope - TEM) là tiêu chuẩn vàng trong đánh giá siêu cấu trúc bên trong đuôi tinh trùng, cho phép quan sát chi tiết các thành phần bên trong nhằm xác định các bất thường về cấu trúc đuôi [17]. Ý nghĩa của phân tích TEM nằm ở khả năng đánh giá tổ chức của sợi trục và các cấu trúc bao quanh sợi trục để xác định sự biểu hiện các đặc điểm điển hình của MMAF. Việc mô tả chính xác những bất thường này có vai trò quan trọng trong quá trình chẩn đoán. Trong khi sử dụng các phương pháp hiển vi thông thường khó nhận diện rõ những biến đổi tại đuôi tinh trùng, khiến các bất thường cấu trúc không thể được đánh giá một cách chính xác.
-
Phân tích di truyền
Các biến thể gây MMAF hiện được xác định chủ yếu thông qua các kỹ thuật phân tích di truyền tiên tiến. Trong thập kỷ gần đây, sự phát triển mạnh mẽ của các phương pháp giải trình tự, đặc biệt là giải trình tự gen thế hệ mới (Next-Generation Sequencing - NGS) và giải trình tự Sanger đã mở ra khả năng phát hiện ngày càng nhiều gen và biến thể bệnh lý liên quan đến kiểu hình MMAF. Tuy nhiên, số lượng gen đã được xác định mới chỉ giải thích một phần nhỏ các trường hợp được báo cáo. Điều này cho thấy các đột biến dẫn đến MMAF rất đa dạng và chưa được khai thác đầy đủ. Trong bối cảnh này, phân tích di truyền trở thành yếu tố then chốt không chỉ giúp xác định nguyên nhân ở mức phân tử mà còn đóng vai trò quan trọng giúp tư vấn di truyền và định hướng lựa chọn chiến lược hỗ trợ sinh sản trong các trường hợp cần đánh giá tiên lượng ICSI hoặc nguy cơ di truyền cho thế hệ sau. Chính vì vậy, giải trình tự gen đã trở thành bước không thể thiếu trong tiếp cận chẩn đoán toàn diện đối với bệnh nhân mắc MMAF [3, 4].
-
Kết quả điều trị hỗ trợ sinh sản ở nhóm bệnh nhân MMAF
Do khả năng vận động của tinh trùng suy giảm nghiêm trọng, công nghệ hỗ trợ sinh sản phù hợp nhất và duy nhất được áp dụng cho bệnh nhân MMAF là tiêm tinh trùng vào bào tương noãn (Intra-Cytoplasmic Sperm Injection - ICSI) [6]. Để thực hiện thành công kỹ thuật ICSI, cần phải lựa chọn được tinh trùng sống từ các kiểu hình tinh trùng bị bất thường ở phần đuôi. Tuy nhiên trong trường hợp mẫu bất động hoàn toàn cần phải có các phương pháp hỗ trợ xác định tinh trùng sống như sử dụng dung dịch nhược trương (Hypo-osmotic Swelling Test - HOS-test), laser hoặc sử dụng chất hóa học nhằm kích thích vận động (papaverina, pentoxifylline, …) [18].
Ở nhóm bệnh nhân MMAF, ICSI đã ghi nhận nhiều kết quả tích cực. Trong báo cáo của Saito và cộng sự (2020), một cặp vợ chồng vô sinh nguyên phát được đánh giá với tinh dịch đồ cho thấy mẫu có tỉ lệ di động thấp và toàn bộ tinh trùng trong mẫu đều bất thường ở đuôi. Phân tích TEM ghi nhận cấu trúc phần bao sợi của đuôi tinh trùng hầu như mất hoặc bị biến dạng nghiêm trọng phù hợp với đặc điểm của DFS và MMAF. Trong chu kỳ điều trị, bệnh nhân có 7 noãn trưởng thành được ICSI. Sau khi chuyển phôi ngày 3, bệnh nhân đã sinh một bé gái khoẻ mạnh [14]. Kết quả khi thực hiện điều trị cho nhóm bệnh nhân MMAF đã được báo cáo với nhiều trường hợp mang các đột biến gen khác nhau và cỡ mẫu lớn. Trong nghiên cứu của Lucile và cộng sự (2021) trên 25 bệnh nhân MMAF cũng ghi nhận tinh dịch đồ có tinh trùng di động tiến tới <5% ở 24/25 bệnh nhân, hình thái điển hình với đuôi ngắn, không có đuôi, đuôi cuộn hoặc không đều, cùng bất thường siêu cấu trúc nổi bật là thiếu cặp vi ống trung tâm 34,5% so với chỉ 3,5% ở nhóm chứng. Sau đó, 40 chu kỳ ICSI được thực hiện cho 20 cặp với tỉ lệ thụ tinh đạt 65,7% với 7 ca sinh sống và 11 trẻ khỏe mạnh [19]. Nghiên cứu Yan‐Wei và cộng sự (2019) với tổng cộng 18 bệnh nhân MMAF mang đột biến CFAP43, CFAP44 hoặc DNAH1 được phân tích. Kết quả tinh dịch đồ đều thể hiện tình trạng tinh trùng bất động nặng trong khi TEM cho thấy rối loạn cấu trúc sợi trục và mất cặp vi ống trung tâm hoặc bao sợi bất thường. Kết quả ICSI của nhóm đột biến CFAP43/CFAP44 với tỉ lệ thụ tinh 76,47% và tỉ lệ mang thai sinh sống đều đạt 50% [20].
Kết quả từ những dữ liệu trên cho thấy rằng, mặc dù tinh trùng ở bệnh nhân MMAF có mức độ bất thường nghiêm trọng về khả năng di động và cấu trúc, nhưng khả năng thụ tinh thông qua phương pháp ICSI vẫn có thể mang lại sự thành công. Đáng chú ý, hiệu quả thụ tinh và kết quả sinh sản ở nhóm bệnh nhân không đồng nhất mà phụ thuộc vào bản chất và kiểu đột biến gen liên quan đến quá trình hình thành MMAF ảnh hưởng chức năng đuôi tinh trùng. Điều này phản ánh sự đa dạng của MMAF, đồng thời cho thấy rằng không phải tất cả các trường hợp đều có tiên lượng sinh sản xấu như nhau. Trên phương diện lâm sàng, các bằng chứng này khẳng định vai trò trung tâm và mang tính quyết định của ICSI khi kỹ thuật này cho phép vượt qua rào cản vận động tinh trùng và tạo cơ hội thụ tinh cho những bệnh nhân vốn không thể thụ tinh tự nhiên. Điều này không chỉ làm rõ tính không đồng nhất về tiên lượng sinh sản ở bệnh nhân MMAF mà còn khẳng định ICSI là chiến lược điều trị không thể thay thế trong các trường hợp vô sinh liên quan đến MMAF.
-
V. Kết luận
Đa bất thường hình thái đuôi tinh trùng (MMAF) là một nhóm bệnh lý hiếm nhưng ngày càng được nhận diện rõ ràng nhờ sự phát triển của các kỹ thuật phân tích siêu cấu trúc và di truyền phân tử. Những bất thường trong cấu trúc đuôi tinh trùng ảnh hưởng nghiêm trọng đến chất lượng và khả năng sinh sản của nam giới tuy nhiên có thể khắc phục bằng công nghệ hỗ trợ sinh sản. Trong tương lai, quá trình phân tích các dữ liệu di truyền, hình thái và chức năng sẽ đóng vai trò quan trọng trong xây dựng các chiến lược cá thể hóa điều trị nhằm cải thiện hơn nữa hiệu quả điều trị cho bệnh nhân MMAF.
Tài liệu tham khảo
-
Graziani, Andrea, et al. "Genetic causes of qualitative sperm defects: a narrative review of clinical evidence." Genes 15.5 (2024): 600.
-
Khan, Ranjha, et al. "Novel loss-of-function mutations in DNAH1 displayed different phenotypic spectrum in humans and mice." Frontiers in Endocrinology 12 (2021): 765639.
-
Long, Rui, et al. "Decreased embryo developmental potential and lower cumulative pregnancy rate in men with multiple morphological abnormalities of the sperm flagella." Frontiers in Endocrinology 15 (2024): 1377780.
-
Wang, Jiaxiong, et al. "Clinical detection, diagnosis and treatment of morphological abnormalities of sperm flagella: A review of literature." Frontiers in Genetics 13 (2022): 1034951.
-
Amargant, Farners, et al. "Insights of the tubulin code in gametes and embryos: from basic research to potential clinical applications in humans." Biology of reproduction 100.3 (2019): 575-589.
-
Wang, Wei-Li, Chao-Feng Tu, and Yue-Qiu Tan. "Insight on multiple morphological abnormalities of sperm flagella in male infertility: what is new?." Asian journal of andrology 22.3 (2020): 236-245.
-
Sha, Yanwei, et al. "DNAH1 gene mutations and their potential association with dysplasia of the sperm fibrous sheath and infertility in the Han Chinese population." Fertility and Sterility 107.6 (2017): 1312-1318.
-
Coutton, Charles, et al. "Mutations in CFAP43 and CFAP44 cause male infertility and flagellum defects in Trypanosoma and human." Nature communications 9.1 (2018): 686.
-
Hussain, Ansar, et al. "A novel homozygous splicing mutation in AK7 causes multiple morphological abnormalities of sperm flagella in patients from consanguineous Pakistani families." Asian Journal of Andrology 27.2 (2025): 189-195.
-
Ghanaeian, Avrin, et al. "Integrated modeling of the Nexin-dynein regulatory complex reveals its regulatory mechanism." Nature Communications 14.1 (2023): 5741.
-
Rafaee, Alemeh, et al. "Structural modeling of human AKAP3 protein and in silico analysis of single nucleotide polymorphisms associated with sperm motility." Scientific Reports 12.1 (2022): 3656.
-
Lv, Mingrong, et al. "Novel FSIP2 variants induce super-length mitochondrial sheath and asthenoteratozoospermia in humans." International Journal of Biological Sciences 19.2 (2023): 393.
-
Ghedir, H., et al. "Meiotic segregation and sperm DNA fragmentation in Tunisian men with dysplasia of the fibrous sheath (DFS) associated with head abnormalities." Journal of assisted reproduction and genetics 31.9 (2014): 1167-1174.
-
Saito, Masato, et al. "Successful pregnancy and delivery achieved following intracytoplasmic sperm injection using teratozoospermic sperm exhibiting marked dysplasia of the fibrous sheath: a case report." Translational andrology and urology 9.2 (2020): 800.
-
Yang, Shen-Min, et al. "Morphological characteristics and initial genetic study of multiple morphological anomalies of the flagella in China." Asian journal of andrology 17.3 (2015): 513-515.
-
Tang, Xiangrong, et al. "A novel variant in CFAP69 causes asthenoteratozoospermia with treatable ART outcomes and a literature review." Journal of Assisted Reproduction and Genetics 40.9 (2023): 2175-2184.
-
Montaser, Mahmoud, et al. "The impact of ultrastructural tail abnormalities on sperm motility among infertile men." Human Andrology 13.13 (2023): 1-8.
-
Baldini, Domenico, et al. "Sperm selection for ICSI: do we have a winner?." Cells 10.12 (2021): 3566.
-
Ferreux, Lucile, et al. "Genetic diagnosis, sperm phenotype and ICSI outcome in case of severe asthenozoospermia with multiple morphological abnormalities of the flagellum." Human Reproduction 36.11 (2021): 2848-2860.
-
Sha, Yan‐Wei, et al. "Patients with multiple morphological abnormalities of the sperm flagella harbouring CFAP44 or CFAP43 mutations have a good pregnancy outcome following intracytoplasmic sperm injection." Andrologia 51.1 (2019): e13151.