CVPH. Ngô Thị Lan Phương
Đơn vị HTSS IVFMD Family, Bệnh viện Đa khoa Gia Đình Đà Nẵng
Giới thiệu
Tác động của ô nhiễm môi trường đến khả năng sinh sản đã trở thành một vấn đề thiết yếu trong y tế công cộng toàn cầu. Sự trưởng thành, thụ tinh và phát triển phôi của noãn phụ thuộc vào năng lượng do ty thể cung cấp; tuy nhiên, với sự gia tăng ô nhiễm môi trường và lão hóa, rối loạn chức năng ty thể và những bất thường về chức năng và chuyển hóa sau đó đã trở thành nguyên nhân hàng đầu gây suy giảm khả năng sinh sản ở nữ giới. Khi rối loạn chức năng ty thể xảy ra trong noãn, hiệu quả chuyển hóa giảm dẫn đến sự trưởng thành nhân và bào tương của noãn bị suy giảm, ảnh hưởng đến chất lượng của noãn, từ đó góp phần làm giảm khả năng sinh sản ở nữ giới và tăng nguy cơ vô sinh, sảy thai và thai nhi lệch bội do rối loạn chức năng buồng trứng [1].
Rối loạn chức năng ty thể có thể gây ra stress oxy hóa, tổn thương DNA ty thể (Mitochondrial DNA – mtDNA) và các đột biến liên quan, thay đổi biểu sinh, khiếm khuyết lắp ráp thoi phân bào, lỗi giảm phân, sai lệch nhiễm sắc thể và rút ngắn telomere, có thể dẫn đến giảm số lượng và chất lượng noãn [2]. Ngược lại, số lượng và chất lượng noãn của phụ nữ có thể giảm theo tuổi tác, điều này có thể dẫn đến suy giảm chức năng ty thể; hai yếu tố này có thể tương tác với nhau. Chức năng chính của ty thể là tạo ra ATP để cung cấp năng lượng cho tế bào thông qua quá trình phosphoryl hóa oxy hóa, và vai trò của ty thể trong quá trình trao đổi chất của tế bào rất đa diện; ty thể cũng điều chỉnh quá trình apoptosis, chu kỳ tế bào, ảnh hưởng đến trạng thái oxy hóa khử của tế bào và cảm nhận năng lượng bằng cách kiểm soát việc sản xuất ROS (Reactive Oxygen Species)và duy trì điện thế màng ty thể. Sự trưởng thành và phát triển của noãn phụ thuộc vào quá trình phosphoryl hóa oxy hóa của ty thể để sản xuất ATP cần thiết. Do đó, ty thể cần phải cung cấp đủ ATP để hỗ trợ cả quá trình tổng hợp sinh học nội bào diễn ra suôn sẻ trong suốt quá trình trưởng thành của noãn và sự phân tách thành công các nhiễm sắc thể trong giai đoạn trưởng thành của noãn. Điều khoản này cũng rất cần thiết để đảm bảo noãn bào bước vào giai đoạn phân chia đầu tiên sau khi thụ tinh và cuối cùng hỗ trợ sự phân chia nhanh chóng của phôi trong giai đoạn phát triển sớm. Do đó, những tác động nghiêm trọng nhất của rối loạn chức năng ty thể là sự suy giảm tổng hợp ATP và tổn thương DNA ty thể, ảnh hưởng tiêu cực đến sự phân tách nhiễm sắc thể và làm suy giảm sự phát triển của phôi [2].
Đặc điểm sinh học của sự lão hóa noãn
Sự suy giảm khả năng sinh sản chủ yếu là do lão hóa buồng trứng, đặc trưng bởi những thay đổi về số lượng và chất lượng noãn. Ở phụ nữ lớn tuổi, sự giảm số lượng noãn chủ yếu là do sự suy giảm nang noãn tự nhiên. Tác động của lão hóa lên noãn chủ yếu biểu hiện dưới dạng sự trưởng thành bị suy giảm của cả nhân và tế bào chất. Khi quá trình trưởng thành của nhân hoặc tế bào chất bị tổn hại sẽ làm tăng tỷ lệ lệch bội của noãn. Sự thất bại trong quá trình trưởng thành này càng làm tăng nguy cơ dị tật phát triển phôi và sảy thai.
Đặc điểm của noãn suy giảm chất lượng
- Bất thường trong quá trình trưởng thành nhân của noãn
Sự gia tăng lệch bội liên quan đến lỗi phân ly giảm phân là một yếu tố quan trọng góp phần làm giảm khả năng sinh sản của tế bào mầm lão hóa, đặc trưng bởi số lượng nhiễm sắc thể (NST) không chính xác, có thể là do lỗi phân ly nhiễm sắc thể trong quá trình giảm phân. Lỗi về số lượng NST ở noãn có thể do một trong hai nguyên nhân: (1) lỗi giảm phân do phân ly sớm các nhiễm sắc tử chị em trong quá trình giảm phân I, đáng lẽ phải tách ra trong quá trình giảm phân II và (2) lỗi giảm phân do phân ly ngược trong quá trình giảm phân.
Các cơ chế dẫn đến lỗi giảm phân ở noãn bào bao gồm: (1) tính toàn vẹn nhiễm sắc thể bị suy giảm do tổn thương DNA tăng lên (ví dụ: đứt gãy chuỗi kép DNA), (2) sự gắn kết nhiễm sắc thể bị suy yếu trong quá trình phân tách nhiễm sắc thể, gây ra sự giảm mức độ các tiểu đơn vị bám dính nhiễm sắc thể, khiến noãn bào dễ bị phân tách nhiễm sắc tử chị em sớm trong nhiễm sắc thể tương đồng, (3) rối loạn chức năng của các điểm kiểm tra lắp ráp thoi phân bào, gây cản trở quá trình phân tách nhiễm sắc thể, dẫn đến phân tách nhiễm sắc thể sớm và sai vị trí nhiễm sắc thể, (4) lỗi tái tổ hợp giảm phân và (5) sự rút ngắn telomere dẫn đến tính toàn vẹn nhiễm sắc thể bị suy giảm [3].
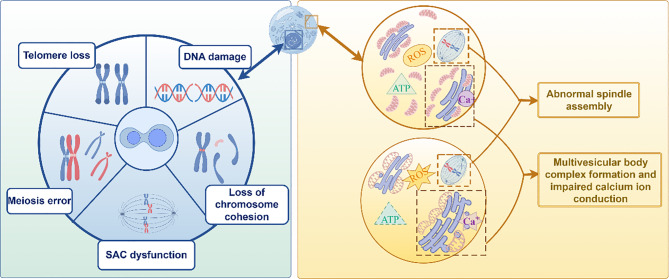
Hình 1. Các nguyên nhân gây bất trưởng thành nhân và tế bào chất của noãn [1].
- Bất thường trong quá trình trưởng thành tế bào chất (TBC) của noãn
Ty thể có ảnh hưởng đáng kể đến quá trình trưởng thành và phát triển TBC của noãn bào. Trong noãn bào trưởng thành, mô hình phân bố ty thể chuyển từ mô hình đồng nhất sang mô hình không đồng nhất, và mô hình phân bố ty thể trong tế bào chất là một chỉ số quan trọng về chất lượng của noãn bào trưởng thành. Bằng cách gây ra sự mất cân bằng trong cân bằng oxy hóa khử, rối loạn chức năng ty thể không chỉ làm suy giảm hoạt động của chuỗi vận chuyển điện tử mà còn phá vỡ sự cân bằng động giữa các bào quan, dẫn đến các bất thường về cấu trúc siêu nhỏ (ví dụ: vỡ màng trong ty thể, tạo túi lưới nội chất) và tổn thương oxy hóa đối với các phân tử sinh học quan trọng trong noãn bào, từ đó làm giảm đáng kể tiềm năng phát triển của noãn bào và tế bào chất của noãn bào. Noãn bào già thường có lưới nội chất trơn (Smooth Endoplasmic Reticulum-SER) bất thường, đặc trưng bởi sự phồng lên của các túi SER riêng lẻ hợp nhất để tạo thành phức hợp thể đa túi (Multivesicular Bodies-MVB). Bất thường SER này liên quan đến sự không ổn định của vi ống, lắp ráp thoi phân bào bất thường và tín hiệu canxi bị suy giảm, ảnh hưởng thêm đến chức năng của noãn bào và tiềm năng phát triển của phôi [4].
Cơ chế phân tử của sự lão hóa noãn do rối loạn chức năng ty thể
- DNA ty thể (mtDNA)
Ty thể là bào quan bán tự trị trong tế bào với DNA riêng của chúng, mtDNA, mã hóa một số protein. Mặc dù hầu hết các protein cần thiết cho chức năng ty thể được mã hóa bởi DNA nhân và được tổng hợp bởi ribosome tế bào chất để vận chuyển có định hướng, hoạt động chuỗi hô hấp bình thường đòi hỏi các gen ty thể nguyên vẹn về cấu trúc và hoạt động bình thường về chức năng. mtDNA đóng vai trò thiết yếu trong việc điều hòa và duy trì chức năng ty thể, và sự tương tác giữa DNA nhân và mtDNA cùng nhau duy trì chức năng ty thể [5].
- Đột biến mtDNA và sự lão hóa noãn
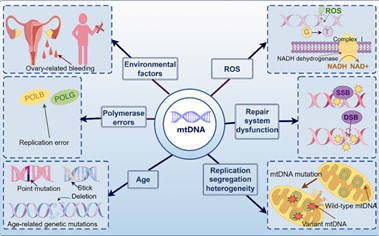
Các đột biến mtDNA có thể là kết quả của một số yếu tố: tổn thương do các yếu tố môi trường, tổn thương do ROS gây ra, lỗi polymerase trong quá trình sao chép DNA, rối loạn chức năng của hệ thống sửa chữa mtDNA, cơ chế phân hủy mtDNA bị tổn thương bị suy yếu và sự tích lũy đột biến liên quan đến tuổi tác (hình 2).
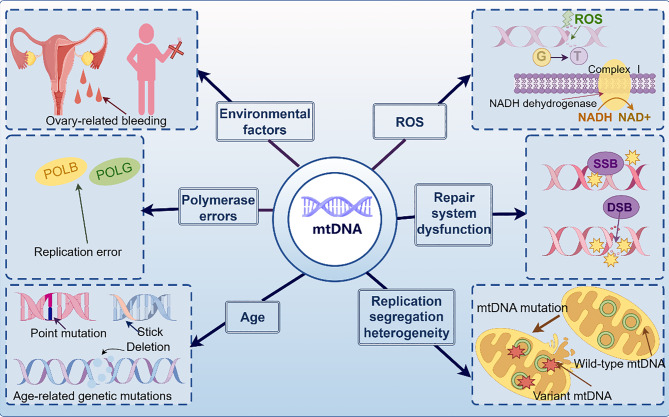
Hình 2. Cơ chế phân tử của đột biến mtDNA trong quá trình lão hóa noãn [1].
OS (Oxidative Stress) có thể gây ra đứt gãy chuỗi kép (double-strand breaks-DSB), một loại tổn thương DNA rất nghiêm trọng. Khi DSB xảy ra ở phụ nữ lớn tuổi, khả năng sai lệch nhiễm sắc thể lớn hơn đáng kể so với ở phụ nữ trẻ. Vì ty thể sao chép DNA của chúng độc lập với chu kỳ tế bào, nên khả năng xảy ra các lỗi sao chép này cao hơn. Hơn nữa, khả năng sửa chữa mtDNA bị hạn chế và chủ yếu dựa vào sửa chữa cắt bỏ bazơ và sửa chữa sai khớp (mismatch repair-MMR). Tuy nhiên, hệ thống MMR của ty thể yếu và không hiệu quả trong việc ngăn ngừa sự tích lũy đột biến. Ngoài ra, ty thể thiếu các con đường sửa chữa tiên tiến hơn, chẳng hạn như sửa chữa cắt bỏ nucleotide và tái tổ hợp tương đồng, điều này làm cho mtDNA đặc biệt dễ bị tích lũy đột biến, dẫn đến tỷ lệ mtDNA bị hư hại cao hơn trong ty thể và làm trầm trọng thêm tổn thương noãn bào. Trong các nghiên cứu trước đây, theo lý thuyết gốc tự do oxy, tổn thương do ROS gây ra có thể là một trong những nguyên nhân chính dẫn đến sự suy giảm chức năng noãn bào liên quan đến tuổi tác. Mức độ ROS tăng cao làm tăng tỷ lệ đột biến mtDNA [6], và sự tích lũy các đột biến mtDNA gây ra cũng như khả năng sửa chữa DNA bị hạn chế, cùng với các lỗi trong quá trình sao chép, dẫn đến tăng tổn thương DNA và tổn thương nhiễm sắc thể. Sự kết hợp của ba yếu tố này dẫn đến tăng tổn thương DNA, suy yếu tính kết dính, rối loạn chức năng của điểm kiểm soát lắp ráp thoi phân bào và các lỗi tái tổ hợp giảm nhiễm, tạo thành một vòng luẩn quẩn dẫn đến sự hình thành các lệch bội nhiễm sắc thể và cuối cùng là sự suy giảm chức năng noãn bào liên quan đến tuổi tác. Ngoài ra, ROS có thể ảnh hưởng gián tiếp đến sự ổn định của mtDNA bằng cách gây ra DSB hơn là trực tiếp thúc đẩy đột biến.
- Thay đổi số lượng bản sao mtDNA trong noãn lão hóa
Nhiều nghiên cứu đã chỉ ra rằng lão hóa noãn có liên quan tích cực đến số lượng bản sao mtDNA giảm. Noãn bào lão hóa chứa ít bản sao mtDNA hơn và hàm lượng mtDNA thấp hơn. Hơn nữa, số lượng bản sao mtDNA trong noãn bào có ảnh hưởng đáng kể đến quá trình thụ tinh noãn bào và phát triển phôi, và trong nghiên cứu này, người ta quan sát thấy rằng phôi của phụ nữ lớn tuổi có số lượng bản sao mtDNA cao hơn so với phôi của phụ nữ trẻ tuổi, điều này có thể là do cơ chế mtDNA bù trừ. Số lượng bản sao mtDNA trong tế bào hạt cumulus (Cumulus Granulosa Cells-CGC) có tương quan với chất lượng phôi và khả năng làm tổ. Hơn nữa, tỷ lệ mtDNA/genotype DNA (gDNA) trong tế bào nang noãn được phát hiện có tương quan nghịch với tuổi của bệnh nhân. Trên cơ sở này, có thể đưa ra giả thuyết rằng số lượng bản sao mtDNA thấp trong tế bào nang noãn có thể ảnh hưởng tiêu cực đến chất lượng phôi trong các chu kỳ IVF. Những phát hiện này cho thấy số lượng bản sao mtDNA thấp trong CCs (Cumulus Cells) có thể ảnh hưởng xấu đến chất lượng phôi trong các chu kỳ IVF và chỉ ra rằng tỷ lệ mtDNA/gDNA của CCs có thể được sử dụng như một dấu ấn sinh học để dự đoán kết quả IVF. Sự thay đổi động về số lượng bản sao mtDNA là một dấu ấn sinh học cốt lõi của quá trình lão hóa sinh sản, và việc tối ưu hóa hệ thống đánh giá và phát triển các chiến lược can thiệp (ví dụ: kết hợp chất chống oxy hóa, cấy ghép ty thể) sẽ mở ra những hướng đi mới để cải thiện kết quả sinh sản của phụ nữ lớn tuổi [1].
Tác động của stress oxy hóa lên chức năng ty thể
- Ảnh hưởng đến quá trình giảm phân
Một số nghiên cứu chỉ ra rằng mức độ ROS có tương quan với các khiếm khuyết của thoi phân bào. Ngoài ra, việc tiếp xúc của tế bào noãn với hydro peroxide (H2O2) làm tăng nguy cơ phân mảnh cũng như khả năng phân chia bất thường của thoi phân bào [7]. Việc sản sinh ROS có thể được gây ra do tiếp xúc với nhiều yếu tố khác nhau, chẳng hạn như kim loại nặng, thuốc lá, khói thuốc, thuốc, các chất ngoại sinh, chất ô nhiễm và bức xạ. Khi noãn bị stress oxy hóa có thể làm phá vỡ quá trình lắp ráp thoi phân bào và chức năng ty thể; gây tổn thương DNA; và gây ra apoptosis trong ống nghiệm, cản trở quá trình trưởng thành của tế bào noãn. Ngoài ra, các chất độc từ môi trường làm tổn thương các cấu trúc (trục phân bào) và chức năng quan trọng (chuyển hóa năng lượng ty thể, tính toàn vẹn của DNA và cân bằng apoptosis/tự thực bào) của tế bào noãn bằng cách gây ra stress oxy hóa liên quan đến ROS, cuối cùng làm suy giảm khả năng và chất lượng trưởng thành của chúng [1].
- Ảnh hưởng đến tính toàn vẹn của telomere
Telomere nằm ở đầu NST và chức năng chính của chúng là duy trì tính toàn vẹn của NST. Khi đầu NST không được sao chép trong quá trình phân chia tế bào, nó dẫn đến sự rút ngắn dần dần của telomere. OS đẩy nhanh quá trình rút ngắn telomere và gây ra phản ứng tổn thương DNA, làm suy giảm sự tăng sinh tế bào, lão hóa noãn hoặc apoptosis [8]. Do đó, chiều dài telomere và hoạt động telomerase có thể đóng vai trò là các dấu ấn sinh học tiềm năng để dự đoán chất lượng tế bào noãn.
Ảnh hưởng của rối loạn chuyển hóa ty thể dẫn đến sự lão hóa tế bào noãn
Những bất thường liên quan đến tuổi tác trong quá trình chuyển hóa ty thể ảnh hưởng đến mức độ tế bào của các chất trung gian và sản phẩm phụ, do đó ảnh hưởng đến chất lượng noãn bào. Những bất thường trong quá trình chuyển hóa ty thể thường được phản ánh qua những thay đổi về mức ATP trong noãn bào. Noãn bào lão hóa biểu hiện sự giảm mức ATP, giảm khả năng sản xuất năng lượng và giảm chức năng ty thể. Điều này dẫn đến giảm chất lượng noãn bào, đặc biệt là giảm hoạt động chuyển hóa, có thể ảnh hưởng đến điều hòa chu kỳ tế bào, hình thành thoi phân bào trong quá trình nguyên phân, phân tách nhiễm sắc thể, thụ tinh, phát triển phôi và làm tổ. Chu trình axit tricarboxylic (chu trình TCA) là một quá trình trung tâm trong chuyển hóa năng lượng ty thể, và tiếp theo chúng tôi tóm tắt các tác động của những bất thường chuyển hóa trong lĩnh vực này đối với sự lão hóa của noãn bào.
- Ảnh hưởng của sự rối loạn chuyển hóa NAD+ trong chu trình TCA lên noãn
Là trung tâm của quá trình chuyển hóa năng lượng và các con đường tín hiệu liên quan đến lão hóa, sự suy giảm hoạt động của chu trình TCA có liên quan chặt chẽ đến các rối loạn chuyển hóa liên quan đến tuổi tác, do đó trở thành mục tiêu phân tử quan trọng cho các biện pháp can thiệp chống lão hóa. Các nghiên cứu đã chỉ ra rằng hoạt động của chu trình TCA giảm đáng kể theo tuổi tác, điều này trực tiếp dẫn đến sự mất cân bằng trong trạng thái oxy hóa khử NAD+/NADH và giảm mức NAD+ nội bào [9]. Sự suy giảm chức năng của con đường de novo gây ra lão hóa buồng trứng sớm: sự thiếu hụt NAD+ gây ra sự thiếu hụt tổng hợp ATP và sự tích tụ quá mức ROS bằng cách ức chế hoạt động phức hợp OXPHOS (Oxidative phosphorylation), từ đó gây ra sự ngừng chu kỳ tế bào bạch cầu hạt (pha G1/S) và kích hoạt con đường apoptosis phụ thuộc vào ty thể. Tóm lại, NAD+ rất cần thiết để duy trì cân bằng oxy hóa khử cho sự phát triển của tế bào noãn, giảm phân bình thường, thụ tinh tế bào noãn và phát triển phôi.
- Ảnh hưởng của sự rối loạn chuyển hóa ATP trong chu trình TCA lên tế bào noãn
Các ty thể khỏe mạnh tạo ra ATP thông qua chu trình TCA và quá trình phosphoryl hóa oxy hóa, và ATP được tạo ra bởi chuỗi hô hấp điện tử của ty thể là nguồn năng lượng chính cho hoạt động sinh học của tế bào; cơ sở năng lượng sinh học này rất cần thiết cho sự cân bằng nội môi của tế bào và khả năng tồn tại của sinh vật. Sự suy giảm kéo dài nồng độ ATP dẫn đến sự gia tăng tương đối hàm lượng AMP nội bào và việc ngăn chặn sản xuất ATP kích hoạt quá trình lão hóa tế bào, được chứng minh bằng sự gia tăng mức độ biểu hiện của hai protein, p16INK4A và p21CIP1/WAF1. Sự suy giảm sản xuất ATP cũng dẫn đến sự gia tăng tỷ lệ AMP (hoặc ADP) so với ATP, gây ra sự mất cân bằng trong quá trình chuyển hóa năng lượng sinh học nội bào. Việc tăng tỷ lệ AMP so với ATP, bằng cách giảm nồng độ ATP hoặc tăng nồng độ AMP ngoại sinh, có thể góp phần vào sự ngừng tăng trưởng tế bào và các đặc điểm lão hóa. Khi tỷ lệ AMP (hoặc ADP) so với ATP tăng lên, điều này lần lượt kích hoạt con đường kinase protein hoạt hóa AMP, cơ chế hoạt động chính xác của AMPK trong quá trình lão hóa tế bào trứng vẫn chưa rõ ràng, do đó cung cấp một hướng nghiên cứu tiềm năng trong tương lai. Khi con đường tín hiệu AMPK được kích hoạt, nó điều chỉnh các enzyme chính trong một số con đường trao đổi chất, bao gồm chuyển hóa lipid và glucose, động lực học ty thể, tự thực bào và tổng hợp protein thông qua quá trình phosphoryl hóa, do đó giúp khôi phục cân bằng năng lượng ty thể, khi bị gián đoạn sẽ gây tổn thương ty thể. Hơn nữa, AMPK là một enzyme cảm nhận năng lượng quan trọng, và sự hoạt hóa AMPK gây ra sự ngừng chu kỳ tế bào, dẫn đến tổn thương tế bào. Mặc dù cơ chế cụ thể về vai trò của AMPK trong quá trình lão hóa noãn bào vẫn chưa rõ ràng, nhưng nó cung cấp một hướng đi tiềm năng cho nghiên cứu trong tương lai [10] [11].
Các chiến lược của ty thể nhằm trì hoãn sự lão hóa của noãn bào
- Các chất chống oxy hóa giúp cải thiện chức năng ty thể
Các chất chống oxy hóa, chủ yếu có nguồn gốc từ chiết xuất thực vật hoặc thực phẩm, khôi phục sự cân bằng động giữa ROS và hệ thống chống oxy hóa nhờ đặc tính chống oxy hóa và khả năng loại bỏ ROS của chúng, do đó làm tăng số lượng bản sao mtDNA, tăng hàm lượng ATP của tế bào noãn và cải thiện hoạt động và chức năng của ty thể. Ngoài ra, loại chất chống oxy hóa này có thể cải thiện các bất thường về thoi phân bào ở tế bào noãn, nâng cao chất lượng trưởng thành trong ống nghiệm và thúc đẩy sự phát triển của phôi [12].
- Liệu pháp thay thế ty thể và tiềm năng của cấy ghép ty thể
- Truyền năng lượng ty thể dòng mầm tự thân (AUGMENT): Công nghệ AUGMENT được thiết kế để chống lại sự không đồng nhất của ty thể bằng cách sử dụng ty thể tự thân có nguồn gốc từ các tế bào soma của phụ nữ (ví dụ: tế bào hạt) để thúc đẩy quá trình kích hoạt sinh năng lượng của trứng và tăng cường khả năng thụ tinh và phát triển phôi. Hiện tại, kỹ thuật AUGMENT vẫn đang trong giai đoạn thử nghiệm và chưa được phê duyệt để sử dụng trong nhiều trường hợp. Ngoài ra, còn thiếu bằng chứng đầy đủ để xác nhận tác dụng tích cực đối với kết quả mang thai hoặc tính an toàn, và việc sử dụng lâm sàng kỹ thuật này đã bị tạm dừng [13].
- Liệu pháp thay thế ty thể (Mitochondrial replacement therapy-MRT): Hai phương pháp cơ bản để thực hiện MRT là chuyển thoi phân bào mẹ (maternal spindle transfer-MST) và chuyển nhân (pronuclear transfer-PNT), giúp cải thiện khả năng sinh sản bằng cách chuyển bộ gen nhân từ noãn bị ảnh hưởng (MST) hoặc noãn đã thụ tinh (PNT) sang tế bào chất “khỏe mạnh” của người hiến tặng. Các kết quả sơ bộ rất hứa hẹn, nhưng cần có các thử nghiệm lâm sàng quy mô lớn hơn để đánh giá đầy đủ tính an toàn và hiệu quả của phương pháp điều trị MST. Vì phôi hoặc trẻ sơ sinh được tạo ra thông qua MRT mang mtDNA của mẹ, các nghiên cứu trong tương lai cũng nên tập trung vào việc kết hợp MRT với chỉnh sửa gen mtDNA để giảm lượng mtDNA xuống mức không thể phát hiện được, cung cấp các hướng nghiên cứu tiềm năng trong tương lai. Sự khác biệt trong các quy định về TTTON ở các quốc gia khác nhau đã dẫn đến một số thách thức về đạo đức và pháp lý, do đó cần có một cách tiếp cận nghiêm ngặt và rõ ràng hơn [14] [15].
Kết luận và triển vọng
Việc sinh con ở phụ nữ lớn tuổi đặt ra thách thức liên quan đến chức năng buồng trứng và chất lượng noãn vì khả năng sinh sản giảm theo tuổi tác và sự lão hóa của noãn. Bài viết này nhằm mục đích làm sáng tỏ các cơ chế phân tử chính dẫn đến các khía cạnh liên quan đến ty thể của sự lão hóa noãn. Stress oxy hóa (OS) và rối loạn chức năng ty thể có liên quan đến sự trưởng thành bất thường của nhân và tế bào chất, và tỷ lệ mắc chứng lệch bội tăng cao ở phụ nữ lớn tuổi là do tổn thương DNA do ROS gây ra, mất tính toàn vẹn của nhiễm sắc thể và rút ngắn telomere. Hơn nữa, mức độ mtDNA đầy đủ và ty thể khỏe mạnh là cần thiết cho quá trình chuyển hóa năng lượng bình thường trong noãn, góp phần vào sự phát triển và trưởng thành của noãn, chức năng buồng trứng bình thường và làm chậm quá trình lão hóa noãn. Hiện nay có các phương pháp để giải quyết sự suy giảm khả năng thụ tinh của noãn bào do tuổi tác và khắc phục ảnh hưởng của rối loạn chức năng ty thể trong tương lai. Tuy nhiên cần nghiên cứu thêm các chiến lược để liên tục cải thiện chất lượng và trẻ hóa noãn bào nhằm tăng tỷ lệ thụ thai và giảm nguy cơ sảy thai ở phụ nữ lớn tuổi.
Tài liệu tham khảo
1. Wang, T., Xu, P., Yuan, J., Chen, H., Guo, X., Gao, J., Wang, Y., Yao, D., Li, X., Liu, B., & Liu, Y. (2025). Mitochondrial dysfunction in oocytes: Implications for fertility and ageing. Journal of Ovarian Research, 18, 186. https://doi.org/10.1186/s13048-025-01764-6
2. Mitochondrial DNA Damage and Its Repair Mechanisms in Aging Oocytes—PMC. (n.d.). Retrieved January 11, 2026, from https://pmc.ncbi.nlm.nih.gov/articles/PMC11642581/
3. Kane, A. J., Brennan, C. M., Xu, A. E., Solís, E. J., Terhorst, A., Denic, V., & Amon, A. (2021). Cell adaptation to aneuploidy by the environmental stress response dampens induction of the cytosolic unfolded-protein response. Molecular Biology of the Cell, 32(17), 1557–1564. https://doi.org/10.1091/mbc.E21-03-0104
4. Ferreira, A. F., Soares, M., Almeida-Santos, T., Ramalho-Santos, J., & Sousa, A. P. (2023). Aging and oocyte competence: A molecular cell perspective. WIREs Mechanisms of Disease, 15(5), e1613. https://doi.org/10.1002/wsbm.1613
5. Heuer, B. (2023). The effects of nuclear DNA mutations on mitochondrial function. Journal of the American Association of Nurse Practitioners, 35(1), 2–4. https://doi.org/10.1097/JXX.0000000000000827
6. Raad, G., Tanios, J., Kerbaj, S., Mourad, Y., Fakih, F., Shamas, F., Azouri, J., & Fakih, C. (2021). Stress Management during the Intracytoplasmic Sperm Injection Cycle May Slow Down First Embryo Cleavage and Accelerate Embryo Compaction: A Pilot Randomized Controlled Trial. Psychotherapy and Psychosomatics, 90(2), 119–126. https://doi.org/10.1159/000512530
7. Al-Zubaidi, U., Adhikari, D., Cinar, O., Zhang, Q.-H., Yuen, W. S., Murphy, M. P., Rombauts, L., Robker, R. L., & Carroll, J. (2020). Mitochondria-targeted therapeutics, MitoQ and BGP-15, reverse aging-associated meiotic spindle defects in mouse and human oocytes. Human Reproduction (Oxford, England), 36(3), 771–784. https://doi.org/10.1093/humrep/deaa300
8. Lin, J., & Epel, E. (2022). Stress and telomere shortening: Insights from cellular mechanisms. Ageing Research Reviews, 73, 101507. https://doi.org/10.1016/j.arr.2021.101507
9. Wang, S., Zheng, Y., Li, J., Yu, Y., Zhang, W., Song, M., Liu, Z., Min, Z., Hu, H., Jing, Y., He, X., Sun, L., Ma, L., Esteban, C. R., Chan, P., Qiao, J., Zhou, Q., Izpisua Belmonte, J. C., Qu, J., … Liu, G.-H. (2020). Single-Cell Transcriptomic Atlas of Primate Ovarian Aging. Cell, 180(3), 585-600.e19. https://doi.org/10.1016/j.cell.2020.01.009
10. Mikhail, A. I., Ng, S. Y., Mattina, S. R., & Ljubicic, V. (2023). AMPK is mitochondrial medicine for neuromuscular disorders. Trends in Molecular Medicine, 29(7), 512–529. https://doi.org/10.1016/j.molmed.2023.03.008
11. Hu, L.-L., Liao, M.-H., Liu, Y.-X., Xing, C.-H., Nong, L.-L., Yang, F.-L., & Sun, S.-C. (2024). Loss of AMPK activity induces organelle dysfunction and oxidative stress during oocyte aging. Biology Direct, 19, 29. https://doi.org/10.1186/s13062-024-00471-4
12. Premature ovarian insufficiency: A review on the role of oxidative stress and the application of antioxidants—PMC. (n.d.). Retrieved January 11, 2026, from https://pmc.ncbi.nlm.nih.gov/articles/PMC10436748/
13. Good practice recommendations on add-ons in reproductive medicine—PMC. (n.d.). Retrieved January 11, 2026, from https://pmc.ncbi.nlm.nih.gov/articles/PMC10628516/
14. Chen, X., Liang, D., Guo, J., Zhang, J., Sun, H., Zhang, X., Jin, J., Dai, Y., Bao, Q., Qian, X., Tan, L., Hu, P., Ling, X., Shen, B., & Xu, Z. (2022). DdCBE-mediated mitochondrial base editing in human 3PN embryos. Cell Discovery, 8, 8. https://doi.org/10.1038/s41421-021-00358-y
15. Yildirim, R. M., & Seli, E. (2024). Mitochondria as therapeutic targets in assisted reproduction. Human Reproduction (Oxford, England), 39(10), 2147–2159. https://doi.org/10.1093/humrep/deae170