CNSH. Lê Thị Quỳnh – IVFMD SIH – Bệnh viện Phụ sản Quốc tế Sài Gòn
-
Tổng quan
Sự thành công của các chu kỳ hỗ trợ sinh sản (HTSS) phụ thuộc phần lớn vào khả năng phát triển của phôi, trong đó nhiễm sắc thể (NST) đóng vai trò quyết định. Sàng lọc di truyền tiền làm tổ (Preimplantation Genetic Screening for Aneuploidy - PGT-A) là một kỹ thuật chẩn đoán cho phép các chuyên viên phôi học đánh giá karyotype của các tế bào lá nuôi phôi (Trophectoderm - TE) trước khi chuyển phôi[1]. Mục tiêu chính là sàng lọc lệch bội và thể khảm nhằm tăng tỷ lệ có thai và giảm nguy cơ sảy thai.
Tuổi mẹ là yếu tố nguy cơ cao ảnh hưởng đến tỷ lệ lệch bội[2]. Yếu tố tinh trùng cũng được nhận định là có liên quan đến chất lượng di truyền của phôi[3]. Dữ liệu gần đây cho thấy tình trạng oligozoospermia nghiêm trọng và chỉ số phân mảnh DNA tinh trùng (DNA Fragmentation Index – DFI) cao có mối liên hệ với sự hình thành thể khảm ở phôi[2].
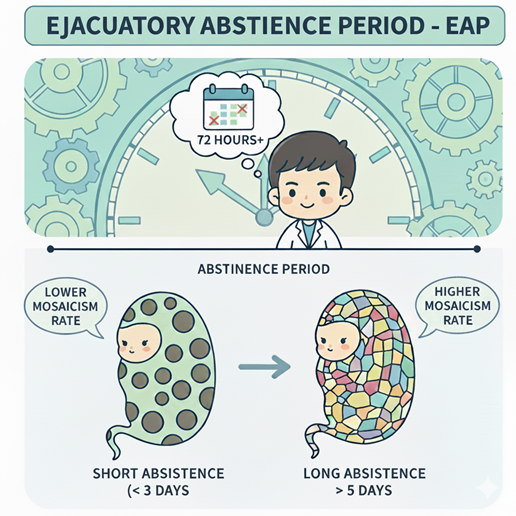
Thời gian kiêng xuất tinh là yếu tố dễ thay đổi, ảnh hưởng đến chất lượng tinh dịch. Tổ chức Y tế Thế giới (World Health Organization - WHO) khuyến nghị thời gian kiêng xuất tinh là 2–7 ngày cho mục đích xét nghiệm tinh dịch đồ[4]. Tuy nhiên, Hiệp hội Sinh sản và Phôi học Châu Âu (European Society of Human Reproduction and Embryology – ESHRE) thu hẹp phạm vi này xuống 3–4 ngày, cho thấy sự cần thiết phải tối ưu hóa các thông số tinh trùng[5].
Giả thuyết được đặt ra rằng việc kiêng xuất tinh kéo dài sẽ làm tăng thời gian lưu trữ tinh trùng trưởng thành trong phần đuôi mào tinh[3]. Quá trình lưu trữ này làm tăng tiếp xúc với các gốc oxy tự do (Reactive Oxygen Species - ROS), gây ra tổn thương DNA. Tổn thương này sau đó được cho là ảnh hưởng đến chất lượng phôi, có khả năng làm tăng các lỗi nguyên phân và tỷ lệ khảm[3].
Bài viết này nhằm mục đích tổng hợp và đánh giá các bằng chứng hiện có về mối quan hệ giữa các khoảng thời gian kiêng xuất tinh khác nhau và NST của phôi, từ đó xem xét thời gian kiêng xuất tinh có thể được sử dụng như một chiến lược can thiệp không xâm lấn trong các chu kỳ HTSS hay không.
-
Cơ sở khoa học về thời gian kiêng xuất tinh và chất lượng tinh trùng
Ảnh hưởng của thời gian kiêng xuất tinh lên các thông số tinh dịch đồ truyền thống
Sự thay đổi thời gian kiêng xuất tinh có tác động rõ rệt và đã được ghi nhận đối với các thông số tinh dịch đồ truyền thống[6]. Việc kéo dài thời gian kiêng, trên 5–7 ngày, dẫn đến sự tích lũy dịch tiết, làm gia tăng tổng số lượng tinh trùng và thể tích tinh dịch.
Tuy nhiên, nghiên cứu của Hanson và cộng sự (2017) cho thấy độ di động tiến tới tối ưu được ghi nhận khi thời gian kiêng xuất tinh dưới 3 ngày[6]. Khi khoảng thời gian này vượt quá 5 ngày, độ di động thường có xu hướng suy giảm, điều này có thể giải thích là do sự lão hóa tự nhiên của tinh trùng do được lưu trữ quá lâu trong đường sinh dục nam.
Mặc dù thời gian kiêng xuất tinh dài có thể giúp gia tăng tổng số lượng tinh trùng, tuy nhiên các tổng quan hiện nay cho thấy không có sự khác biệt đáng kể về tỷ lệ thụ tinh trong cả kỹ thuật IVF và ICSI giữa các khoảng thời gian kiêng xuất tinh khác nhau[6]. Bên cạnh đó, các bằng chứng hiện có từ các nghiên cứu lại chỉ ra tính toàn vẹn DNA lại có vai trò quan trọng trong việc quyết định sự thụ tinh thành công và sự phát triển của phôi[7].
Tính toàn vẹn của DNA tinh trùng và thời gian kiêng xuất tinh
Tinh trùng không có cơ chế tự sửa chữa DNA sau khi quá trình phiên mã và dịch mã ngừng lại ở giai đoạn sinh tinh[8]. Trong suốt thời gian kiêng xuất tinh, tinh trùng trưởng thành chủ yếu được lưu trữ tại phần đuôi mào tinh, nơi thường xuyên tiếp xúc với ROS[9]. Thời gian kiêng xuất tinh càng kéo dài, thời gian tinh trùng phải chịu stress oxy hóa càng lâu, dẫn đến sự tích lũy của các tổn thương DNA[3]. Bên cạnh yếu tố stress oxy hóa sau tinh hoàn, tổn thương DNA còn có thể xuất phát từ các lỗi nội tại trong quá trình sinh tinh, chẳng hạn như sự cô đặc chromatin không hoàn chỉnh do thiếu hụt protamine hoặc quá trình apoptosis bị gián đoạn[10].
Nhiều nghiên cứu phân tích tổng hợp đã xác nhận mối tương quan nghịch giữa thời gian kiêng xuất tinh và DFI[11]. Việc duy trì khoảng thời gian kiêng ngắn (dưới 48 giờ) hoặc tần suất xuất tinh cao (từ 2 lần/tuần trở lên) có liên quan trực tiếp đến việc giảm đáng kể DFI, với mức giảm trung bình được ghi nhận là khoảng 3,82%[12]. Đặc biệt, các phác đồ kiêng xuất tinh cực ngắn trong vòng 1–4 giờ (mẫu thứ hai được lấy ngay sau mẫu đầu tiên) đã được chứng minh là giúp giảm DFI xuống mức tối thiểu[13]. Cơ chế của chiến lược này là giúp cơ thể nhanh chóng loại bỏ nhóm tinh trùng cũ đã bị tổn thương DNA do tích lũy lâu ngày trong mào tinh, từ đó thu nhận được nhóm tinh trùng mới hơn với chất lượng di truyền tốt hơn[5].
Mặc dù mục tiêu của kiêng xuất tinh cực ngắn là giảm DFI do ROS, một số nghiên cứu chỉ ra rằng thời gian kiêng xuất tinh quá ngắn có thể làm tăng tỷ lệ tinh trùng có lỗi cấu trúc chromatin (đóng gói DNA chưa hoàn chỉnh, thường liên quan đến thiếu protamine)[14]. Sự trưởng thành cuối cùng của tinh trùng diễn ra trong mào tinh, và việc xuất tinh quá sớm có thể làm gián đoạn quá trình này.
Do đó, việc giảm DFI có thể đi kèm với nguy cơ tăng nhẹ các lỗi cấu trúc chromatin nếu thời gian kiêng xuất tinh quá gần nhau. Điều này củng cố sự cần thiết phải xác định một ngưỡng kiêng xuất tinh lý tưởng để có thể loại bỏ tinh trùng được
-
Thời gian kiêng xuất tinh và nhiễm sắc thể của phôi
Các nghiên cứu hồi cứu lớn cho đến hiện tại vẫn chưa có bằng chứng và số liệu thống kê đủ mạnh giữa thời gian kiêng xuất tinh trong phạm vi tiêu chuẩn (2–7 ngày) và tỷ lệ phôi nguyên bội. Điều này có thể được giải thích bằng cơ chế sinh học của noãn. Noãn có khả năng sửa chữa DNA vốn có, cho phép bù đắp và sửa chữa một phần tổn thương DNA tinh trùng sau khi thụ tinh[15].
Tuy nhiên, khả năng sửa chữa này là có giới hạn. Nếu mức độ DFI tinh trùng vượt quá ngưỡng sửa chữa của noãn, phôi có thể ngừng phát triển hoặc phát triển bất thường. Hơn nữa, khả năng sửa chữa DNA của noãn suy giảm đáng kể theo tuổi mẹ[15]. Đối với phụ nữ lớn tuổi, phôi dễ bị tổn thương bởi các khiếm khuyết từ tinh trùng hơn nhóm phụ nữ trẻ tuổi.
DFI không phải là nguyên nhân chính gây ra lệch bội nhưng lại có liên quan đến chất lượng phôi và các lỗi nguyên phân xảy ra sau hợp tử, dẫn đến khảm.
DFI và tỷ lệ phôi nguyên bội
Nhiều phân tích tổng hợp gần đây cho thấy mối tương quan nghịch giữa DFI cao và tỷ lệ phôi nguyên bội. Các nghiên cứu PGT-A cho thấy tỷ lệ phôi nguyên bội giảm rõ rệt ở các cặp vợ chồng có DFI cao. Nghiên cứu hồi cứu của Fu và cộng sự (2023) thực hiện trên 426 chu kỳ ICSI kết hợp với PGT-A cho kết quả tỷ lệ phôi nguyên bội là 29,7% ở nhóm DFI cao so với 41,3% ở nhóm DFI thấp[16]. Điều này ủng hộ việc tích hợp đánh giá DFI vào quy trình đánh giá vô sinh, đặc biệt trong các chu kỳ HTSS đã từng thất bại trước đó.
DFI và cơ chế hình thành khảm
Phôi khảm là kết quả của lỗi nguyên phân NST, có thể xảy ra do NST không ổn định hoặc do tổn thương DNA chưa được sửa chữa.
Tổn thương DNA tinh trùng, đặc biệt là các đứt gãy sợi đôi, được suy đoán là gây ra các lỗi nguyên phân, dẫn đến sự hình thành phôi khảm. Nghiên cứu của Kahraman và cộng sự (2020) chỉ ra rằng tỷ lệ phôi khảm và sự phát triển hình thái bất thường cao hơn đáng kể ở nhóm bệnh nhân có nồng
Mặc dù tuổi mẹ là yếu tố nguy cơ cao gây ra lệch bội, vai trò của thời gian kiêng xuất tinh trở nên quan trọng hơn ở các cặp vợ chồng lớn tuổi. Khi tuổi mẹ tăng lên, khả năng sửa chữa DNA của noãn giảm đi[15]. Trong bối cảnh này, ngay cả mức DFI tinh trùng vừa phải cũng có thể vượt quá khả năng sửa chữa của noãn già hoá, dẫn đến sự bất ổn NST sớm và tăng nguy cơ khảm hoặc ngừng phát triển phôi. Do đó, việc can thiệp các phác đồ kiêng xuất tinh cực ngắn là một chiến lược quan trọng và cần thiết ở các cặp vợ chồng có DFI cao kết hợp với tuổi mẹ cao[5].
-
Kết luận
Thời gian kiêng xuất tinh là một yếu tố có khả năng can thiệp về mặt lâm sàng, chủ yếu thông qua việc điều chỉnh mức DFI tinh trùng. Việc xem xét sử dụng phác đồ kiêng xuất tinh cực ngắn là một chiến lược hiệu quả để giảm thiểu DFI, từ đó giảm nguy cơ lỗi nguyên phân ở phôi. Nhóm bệnh nhân được hưởng lợi lớn nhất từ phác đồ này là nhóm nam giới có DFI cao và các cặp vợ chồng có noãn già hoá với khả năng sửa chữa DNA kém (thường là tuổi mẹ cao).
Tài liệu tham khảo:
[1] Homer H. A. (2019). Preimplantation genetic testing for aneuploidy (PGT-A): The biology, the technology and the clinical outcomes. The Australian & New Zealand journal of obstetrics & gynaecology, 59(2), 317–324. https://doi.org/10.1111/ajo.12960.
[2] Cascales et al. (2023). Factors associated with embryo mosaicism: a systematic review and meta-analysis. Journal of Assisted Reproduction and Genetics, 40(10), 2317-2324.
[3] Gao et al. (2025). Effect of maternal age, embryo number and quality on pregnancy outcome during frozen embryo transfer cycle. Frontiers in Endocrinology, 16, 1596178. https://doi.org/10.3389/fendo.2025.1596178
[4] Russo et al. (2025). Ejaculatory abstinence duration impacts semen parameters: Insights from a retrospective analysis in male infertility on 23,527 analyses. Frontiers in Endocrinology, 16, 1529262. https://doi.org/10.3389/fendo.2025.1529262
[5] Dexeus Campus. (2021, 2 tháng 11). A short period of ejaculatory abstinence can improve the results of reproductive treatments. Dexeus Campus. https://www.dexeuscampus.com/en/blog/assisted-reproduction/short-period-ejaculatory-abstinence-results-reproductive-treatments/
[6] Hanson et al. (2018). The impact of ejaculatory abstinence on semen analysis parameters: a systematic review. Journal of assisted reproduction and genetics, 35(2), 213-220.
[7] Zhao et al. (2023). Outcomes comparison of testicular versus ejaculated sperm for intracytoplasmic sperm injection in infertile men with high DNA fragmentation: updated systematic review and meta-analysis. Translational Andrology and Urology, 12(12), 1785.
[8] González-Marín et al. (2012). Types, causes, detection and repair of DNA fragmentation in animal and human sperm cells. International journal of molecular sciences, 13(11), 14026-14052.
[9] Karabulut et al. (2025). Impact of Maternal Age on the Repairing Capacity of Oocytes on Paternal DNA Damage. Reproductive Sciences, 1-7.
[10] Sørensen et al. (2023). The influence of male ejaculatory abstinence time on pregnancy rate, live birth rate and DNA fragmentation: a systematic review. Journal of Clinical Medicine, 12(6), 2219.
[11] Agarwal et al. (2017). The Society for Translational Medicine: clinical practice guidelines for sperm DNA fragmentation testing in male infertility. Translational andrology and urology, 6(Suppl 4), S720.
[12] Sokol et al. (2021). The effect of ejaculatory abstinence interval on sperm parameters and clinical outcome of ART. A systematic review of the literature. Journal of clinical medicine, 10(15), 3213.
[13] Raditya et al. (2024). Impact of shorter abstinence periods on semen parameters: A systematic review and meta-analysis. The World Journal of Men's Health, 43(3), 563.
[14] Deng et al. (2020). The impact of culture conditions on blastocyst formation and aneuploidy rates: a comparison between single-step and sequential media in a large academic practice. Journal of assisted reproduction and genetics, 37(1), 161-169.
[15] Li et al. (2025). Perspective in the mechanisms for repairing sperm DNA damage. Reproductive Sciences, 32(1), 41-51.
[16] Wan et al. (2025). Effect of sperm DNA fragmentation on embryo euploidy rate in assisted reproductive technologies: a systematic review and meta-analysis. European Journal of Medical Research, 30(1), 1138.
[17] Kahraman et al. (2020). High rates of aneuploidy, mosaicism and abnormal morphokinetic development in cases with low sperm concentration. Journal of Assisted Reproduction and Genetics, 37(3), 629–640. https://doi.org/10.1007/s10815-019-01673-w
[18] Tarozzi et al. (2019). Male factor infertility impacts the rate of mosaic blastocysts in cycles of preimplantation genetic testing for aneuploidy. Journal of Assisted Reproduction and Genetics, 36(10), 2047–2055. https://doi.org/10.1007/s10815-019-01584-w