CNSH. Nguyễn Ngọc Trúc Phương, CNSH. Tăng Lê Thái Ngọc - ThS. Đặng Thị Huyền Trang
Bệnh viện Mỹ Đức
-
I. Giới thiệu chung
Ngày nay, tình trạng hiếm muộn đang trở thành vấn đề sức khỏe sinh sản mang tính toàn cầu, với nguyên nhân bắt nguồn từ cả nam và nữ. Ở nam giới, chất lượng tinh trùng là một trong những yếu tố quyết định khả năng sinh sản. Trong đó, di động tiến tới đóng vai trò then chốt giúp tinh trùng vượt qua hàng loạt rào cản sinh lý trong quá trình tiếp cận noãn. Khả năng này không chỉ quyết định sự thành công của thụ tinh tự nhiên, mà còn phản ánh tính toàn vẹn về cấu trúc và hiệu quả vận hành của toàn bộ hệ thống sinh học bên trong tinh trùng.
Sự di động của tinh trùng phụ thuộc chủ yếu vào hoạt động tạo năng lượng của ty thể, yếu tố quyết định không chỉ ở số lượng mà còn ở hiệu quả chuyển hoá năng lượng của từng ty thể. Theo Donatella và cộng sự (2011) nhận định: “Điện thế màng ty thể là thông số phản ánh tốt nhất chức năng của ty thể và là chỉ báo trực tiếp về trạng thái năng lượng của tế bào” [1]. Do đó, việc hiểu rõ các lý thuyết cơ bản về điện thế màng là cần thiết để làm sáng tỏ vai trò của ty thể đối với di động của tinh trùng và tiềm năng ứng dụng trong lâm sàng.
-
II. Tổng quan về điện thế màng ty thể (Mitochondrial membrane potential – MMP)
Định nghĩa
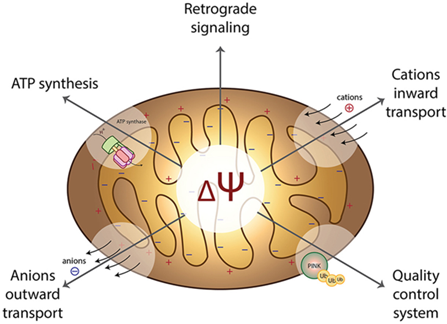
Điện thế màng ty thể được hình thành từ các phản ứng oxy hoá khử trong chu trình Krebs, đóng vai trò như dạng dự trữ năng lượng trung gian và được ATP synthase sử dụng để tổng hợp ATP. Các phản ứng này gây ra sự chênh lệch điện tích và nồng độ proton, tạo thành điện thế điện hoá của ion H⁺ xuyên qua màng trong ty thể [2]. Ở một ty thể hoạt động bình thường, mức chênh lệch điện thế giữa hai bên của màng trong sẽ dao động trong khoảng 180 – 200mV [3].
Cơ chế hình thành điện thế màng ty thể
Một ty thể có cấu trúc bao gồm màng ngoài, khoang gian màng, màng trong gấp nếp tạo thành các mào chứa chất nền ty thể, ribosome và DNA. Tại màng trong, chuỗi truyền electron (Electron transport chain – ETC) gồm bốn phức hợp I–IV sẽ vận chuyển electron và bơm proton H⁺ vào khoang gian màng. Quá trình bơm proton này tạo sự chênh lệch điện hoá, hình thành điện thế màng ty thể cần thiết cho quá trình tạo năng lượng ATP.
Trong quá trình hô hấp tế bào, khi các phân tử mang điện tử như NADH và FADH2 đi qua các phức hợp I, III và IV tại màng trong ty thể, năng lượng electron được giải phóng từ quá trình này sẽ được sử dụng để bơm proton H⁺ từ chất nền ty thể ra khoang gian màng. Sự tích luỹ proton ở khoang gian màng tạo nên sự chênh lệch về nồng độ và điện tích giữa hai mặt của màng trong ty thể. Trong đó, khoang gian màng trở nên tích điện dương hơn, trong khi chất nền ty thể mang điện âm. Sự chênh lệch này chính là cơ sở tạo nên điện thế màng ty thể. Do đó, điện thế màng càng cao phản ánh mức độ tích luỹ proton H⁺ càng lớn và cho thấy chuỗi truyền electron đang hoạt động hiệu quả.
Sự hình thành điện thế màng thúc đẩy proton H⁺ di chuyển trở lại chất nền ty thể thông qua ATP synthase (Hình 1). Khi proton đi qua các vị trí gắn chuyên biệt trên enzyme, lực cơ học mà chúng tạo ra làm quay rotor của ATP synthase, tạo ra năng lượng cung cấp cho quá trình tổng hợp ATP từ ADP và phosphate vô cơ [4].

Hình 1: Cơ chế hình thành điện thế màng ty thể và tổng hợp ATP [4]
Phương pháp đánh giá điện thế màng ty thể
Hiện nay, phương pháp phổ biến để đánh giá điện thế màng ty thể tinh trùng là sử dụng thuốc nhuộm huỳnh quang. Các thuốc nhuộm mang điện tích dương sẽ bị hút vào và tập trung tại màng trong ty thể – nơi có điện tích âm khi điện thế màng được duy trì. Trong điều kiện điện thế màng cao, thuốc nhuộm sẽ được giữ lại trong ty thể với nồng độ lớn, từ đó phát ra tín hiệu huỳnh quang mạnh. Ngược lại, khi điện thế màng ty thể suy giảm, thuốc nhuộm không thể tích lũy hiệu quả mà thay vào đó phân bố khuếch tán trong bào tương, dẫn đến tín hiệu huỳnh quang yếu hơn. Dưới ánh sáng kích thích ở bước sóng thích hợp, cường độ huỳnh quang thu được phản ánh trực tiếp mức độ phân cực của màng trong ty thể tại thời điểm đánh giá [2].
Trong lĩnh vực nghiên cứu, việc đánh giá điện thế màng ty thể được thực hiện thông qua hai nhóm thuốc nhuộm gồm thuốc nhuộm đơn màu và thuốc nhuộm hai màu. Trong đó, thuốc nhuộm đơn màu (TMRE, Rhodamine 123 và MitoTracker Red CMXRos) (Hình 2) hoạt động theo nguyên lý cường độ huỳnh quang tăng tỉ lệ thuận với điện thế màng ty thể. Nhóm thuốc nhuộm hai màu (JC-1 và DiOC₂(3)) (Hình 3) hoạt động theo nguyên lý khi điện thế màng cao, thuốc nhuộm phát tín hiệu ưu thế ở kênh huỳnh quang thứ nhất, khi điện thế màng thấp tín hiệu chuyển sang kênh huỳnh quang thứ hai.

Hình 2: Hình ảnh minh hoạ cho thuốc nhuộm đơn màu [5]

Hình 3: Hình ảnh minh hoạ cho thuốc nhuộm hai màu [6]
Hiện nay, phương pháp phân tích tế bào dòng chảy (Flow cytometry) được xem là tiêu chuẩn tham chiếu trong các nghiên cứu về điện thế màng ty thể tinh trùng, do khả năng đánh giá chính xác và nhất quán trên số lượng tế bào lớn. Dựa trên đặc tính phát huỳnh quang của các thuốc nhuộm, phương pháp Flow cytometry được sử dụng để phân tích nhanh các tế bào đơn lẻ khi chúng di chuyển trong dòng chảy đi qua tia laser. Mỗi tế bào được ghi nhận dựa trên tín hiệu tán xạ ánh sáng và huỳnh quang. Các tín hiệu huỳnh quang từ thuốc nhuộm, protein huỳnh quang hoặc kháng thể gắn huỳnh quang giúp nhận diện và đo lường các dấu ấn phân tử. Nhờ vậy, phương pháp này có thể đánh giá nhiều đặc tính của quần thể tế bào trong thời gian ngắn, hỗ trợ phân tích thành phần, chức năng và chọn lọc tế bào phục vụ các nghiên cứu [7].
Dựa trên nguyên lý tích lũy thuốc nhuộm, quy trình đánh giá sẽ được tham khảo từ bài báo do Ramió-Llunell và cộng sự (2022) mô tả. Cụ thể, mẫu tinh trùng sau thu nhận được chuẩn bị bằng kỹ thuật thang nồng độ hoặc Swim-up, sau đó điều chỉnh mật độ về khoảng 1–5×10⁶ tế bào/mL. Mẫu sau đó được ủ với thuốc nhuộm huỳnh quang (ví dụ JC-1 hoặc TMRE) trong điều kiện tránh ánh sáng, đồng thời chuẩn bị mẫu đối chứng xử lý chất phá cực màng nếu cần để xác định ngưỡng tín hiệu. Kế tiếp, mẫu được chạy trên hệ thống Flow cytometry với thiết lập cổng phân tích nhằm chọn quần thể tinh trùng và loại trừ mảnh vụn hoặc cụm tế bào. Tín hiệu huỳnh quang thu nhận tại các kênh phù hợp được sử dụng để định lượng tỉ lệ tinh trùng có điện thế màng cao và thấp [8].
Tỉ lệ tinh trùng có điện thế màng cao hoặc thấp được tính bằng công thức:
% Tinh trùng có MMPcao/thấp = N/Ntổng
Trong đó:
N: số tinh trùng có điện thế màng cao/thấp
N tổng: tổng số tinh trùng trong toàn bộ mẫu
Mục tiêu của việc xác định tỉ lệ tinh trùng có điện thế màng ty thể cao/thấp là đánh giá tình trạng phân cực màng và mức năng lượng của ty thể trong quần thể tinh trùng. Đồng thời, việc theo dõi tỉ lệ này cho phép đánh giá sự thay đổi chức năng ty thể dưới các điều kiện thí nghiệm hoặc sau các bước xử lý mẫu, hỗ trợ phân tích và so sánh trong nghiên cứu.
III. Các yếu tố ảnh hưởng tới điện thế màng ty thể
Điện thế màng là thước đo trực tiếp đánh giá hiệu quả hoạt động hô hấp của ty thể tinh trùng và phụ thuộc vào sự toàn vẹn của hệ thống truyền electron cũng như môi trường nội bào cân bằng. Tuy nhiên, giá trị này không mang tính cố định mà có thể suy giảm dưới tác động của nhiều yếu tố sinh học như đột biến gen, stress oxy hoá hay các quy trình kỹ thuật trong hỗ trợ sinh sản cũng gây tăng stress oxy hoá và ảnh hưởng bất lợi đến điện thế màng ty thể tinh trùng.
Đột biến gen
Trong bối cảnh đánh giá các nguyên nhân ảnh hưởng đến điện thế màng ty thể, yếu tố di truyền đóng vai trò quyết định tính toàn vẹn và hiệu suất hoạt động của các tiểu đơn vị thuộc chuỗi truyền electron. Đột biến gen tại các phức hợp này có thể làm giảm khả năng bơm proton, từ đó suy giảm điện thế màng ty thể. Các đột biến MT-ND1, MT-ND4 và MT-ND6 tại phức hợp I liên quan quá trình chuyển electron từ NADH sang Coenzyme Q và hiệu quả bơm proton [9]. Đột biến UQCRFS1 ở phức hợp III gây tổn thương trung tâm Rieske Fe-S, làm gián đoạn chu trình Q-cycle, ảnh hưởng sự chênh lệch điện tích proton [10]. Ngoài ra, các biến thể ở COX10 hoặc MT-CO1 của phức hợp IV làm suy giảm hoạt tính Cytochrome C oxidase, cản trở truyền electron đến oxy và bơm proton [11, 12]. Mặc dù những bằng chứng hiện tại chỉ đang mô tả cơ chế, các quan sát này vẫn góp phần làm rõ các đột biến tiềm năng có thể ảnh hưởng điện thế màng ty thể và cung cấp nền tảng cho các đánh giá thực nghiệm trong tương lai.
Stress oxy hoá
Stress oxy hoá được xem là cơ chế trung tâm chi phối sự suy giảm điện thế màng ty thể, qua đó ảnh hưởng đến chức năng tinh trùng. Các bằng chứng hiện tại cho thấy yếu tố bệnh lý có thể thúc đẩy sản sinh gốc oxy hoá (ROS - Reactive oxygen species) gây tổn thương màng trong ty thể, dẫn đến giảm chênh lệch proton và điện thế màng. Các bệnh không lây nhiễm như tim mạch, ung thư; bệnh chuyển hoá như tiểu đường, gan nhiễm mỡ không do rượu đều được ghi nhận làm gia tăng stress oxy hoá và giảm điện thế màng [13]. Trong giãn tĩnh mạch thừng tinh, nhiệt độ bìu tăng và ứ trệ tuần hoàn có thể dẫn tới stress oxy hoá, tổn thương chức năng ty thể thể hiện qua giảm điện thế màng và suy giảm chức năng tinh trùng [14]. Trong nghiên cứu của Tie và cộng sự (2023), nhóm tác giả đã tiến hành so sánh điện thế màng ty thể tinh trùng giữa nhóm người mắc giãn tĩnh mạch thừng tinh độ 2–3 và nhóm người khỏe mạnh. Kết quả cho thấy tỉ lệ tinh trùng có điện thế màng ty thể cao ở nhóm giãn tĩnh mạch thừng tinh giảm đáng kể so với nhóm khỏe mạnh với sự khác biệt có ý nghĩa thống kê (p < 0,01) [15]. Những phát hiện này chứng minh rằng giãn tĩnh mạch thừng tinh có thể làm suy giảm chức năng ty thể, góp phần ảnh hưởng tiêu cực đến chất lượng tinh trùng và tiềm năng sinh sản ở nam giới.
Kỹ thuật hỗ trợ sinh sản
Bên cạnh các nhóm yếu tố nội sinh, một số kỹ thuật trong hỗ trợ sinh sản cũng có thể làm tăng stress oxy hoá và ảnh hưởng đến điện thế màng ty thể. Trữ lạnh tinh trùng là kỹ thuật có khả năng gây tổn thương ty thể do hình thành tinh thể băng và thay đổi áp lực thẩm thấu, làm hỏng màng trong, gây rò rỉ ion và giảm chênh lệch proton (H⁺) qua màng. Sự tổn thương này còn thúc đẩy sản sinh ROS, giảm hiệu quả bơm proton của các phức hợp trong chuỗi truyền electron, điện thế màng và tổng hợp ATP [16]. Trong nghiên cứu của O’Connell và cộng sự (2002), đánh giá trên mẫu tinh trùng tươi cho thấy trữ lạnh làm giảm đáng kể tỉ lệ tinh trùng có ty thể còn hoạt động (62,3% - 39,8%), đồng thời điện thế màng ty thể giảm (25,3% - 13,2%) với p < 0,0001. Bên cạnh đó, tỉ lệ tinh trùng di động tiến tới cũng giảm (22,9% - 13,6%) với p < 0,0001 [17]. Những kết quả này cung cấp bằng chứng thực nghiệm rõ ràng rằng quy trình trữ lạnh gây suy giảm điện thế màng và chức năng ty thể, qua đó ảnh hưởng đến khả năng di động của tinh trùng.
Một kỹ thuật khác là chuẩn bị tinh trùng với quy trình có bước ly tâm (thang nồng độ hoặc Swim-up) cũng có thể gây stress cơ học và stress oxy hoá dẫn đến tổn thương màng tế bào và màng ty thể. Sự tăng sinh ROS nội bào và rối loạn cấu trúc ty thể làm giảm điện thế màng và hiệu quả sản xuất ATP, từ đó ảnh hưởng đến khả năng di động, tính toàn vẹn DNA và kích hoạt apoptosis. Nghiên cứu của Huidrom và cộng sự (2020) đã so sánh mức độ tổn thương ty thể từ thời điểm 0 giờ đến 18 giờ sau xử lý bằng các phương pháp chuẩn bị tinh trùng có ly tâm như thang nồng độ, Swim-up so với phương pháp không ly tâm (Migration sedimentation - MS). Kết quả cho thấy mức độ tổn thương ty thể tăng theo thời gian ở cả ba phương pháp. Sau 6 giờ, mẫu xử lý bằng phương pháp thang nồng độ ghi nhận tổn thương ty thể cao hơn khoảng 5 - 8% so với Swim-up và MS. Đến 18 giờ, mức chênh lệch tăng rõ rệt, phương pháp thang nồng độ cao hơn khoảng 13 - 15% so với hai phương pháp còn lại [18]. Dữ liệu này cho thấy phương pháp ly tâm có thể ảnh hưởng bất lợi đến cấu trúc và chức năng ty thể, góp phần làm suy giảm điện thế màng và chất lượng tinh trùng sau xử lý.
IV. Chiến lược cải thiện điện thế màng ty thể
Tinh trùng vốn có khả năng chống oxy hoá nội sinh hạn chế, nên khi ROS tăng cao, điện thế màng giảm, kéo theo giảm khả năng sản xuất ATP và di động [19]. Do đó, bổ sung các chất chống oxy hoá được xem là biện pháp tiềm năng nhằm ổn định điện thế màng, hạn chế tổn thương và hỗ trợ bảo tồn chức năng của tinh trùng khi can thiệp các kỹ thuật hỗ trợ sinh sản. Cụ thể nghiên cứu của Fang và cộng sự (2020) được tiến hành trên tinh trùng cừu đực trưởng thành gồm nhóm không bổ sung Melatonin và nhóm được bổ sung Melatonin (10⁻⁷M) vào môi trường trữ lạnh. Kết quả cho thấy Melatonin làm cải thiện điện thế màng ty thể, thể hiện qua tỉ lệ tinh trùng có điện thế màng cao nhiều hơn đáng kể so với nhóm đối chứng (p < 0,05) [20]. Tương tự, nghiên cứu của Condorelli và cộng sự (2012) đánh giá tác dụng của Myo-inositol trên hai nhóm tinh trùng bình thường và OAT (Oligoasthenoteratozoospermia) cho thấy sự gia tăng tỉ lệ tinh trùng có điện thế màng cao và cải thiện độ di động ở nhóm OAT khi tinh trùng được ủ với Myo-inositol trong 2 giờ (p < 0,05) [21]. Những nghiên cứu này cho thấy bổ sung chất chống oxy hoá có thể hỗ trợ bảo tồn điện thế màng ty thể và chức năng tinh trùng, đặc biệt ở các mẫu suy giảm chất lượng. Ngoài ra, các chất chống oxy hoá khác như Glutathione, CoQ10 cũng được báo cáo có khả năng trung hòa ROS, hạn chế tổn thương màng trong ty thể và hỗ trợ duy trì sản xuất ATP. Mặc dù mức độ bằng chứng còn khác nhau giữa các chất và mô hình nghiên cứu, xu hướng chung cho thấy các chiến lược đều góp phần cải thiện điện thế màng ty thể và chất lượng tinh trùng [22].
Mặc dù điện thế màng ty thể cho thấy tiềm năng trong đánh giá chức năng tinh trùng nhưng nhiều thách thức kỹ thuật hiện vẫn cản trở việc ứng dụng trong thực hành lâm sàng. Đối với phương pháp đánh giá, từng loại thuốc nhuộm có đặc điểm phát huỳnh quang, điều kiện xử lý mẫu và yêu cầu thiết bị phân tích riêng biệt, dẫn đến sự khác biệt đáng kể trong quy trình thao tác. Sự thiếu thống nhất này gây khó khăn trong chuẩn hoá kỹ thuật và so sánh kết quả nghiên cứu giữa các phòng xét nghiệm. Bên cạnh đó, bằng chứng lâm sàng hiện tại chưa đủ mạnh để thiết lập ngưỡng chuẩn hoá. Nghiên cứu của Marchetti và cộng sự (2012) cho thấy tỉ lệ tinh trùng có điện thế màng ty thể cao > 64% liên quan đến tỉ lệ thành công IVF/ICSI và có khả năng dự đoán vượt trội so với chỉ số di động tiến tới. Tuy nhiên, ngưỡng này chưa được chấp nhận rộng rãi do thiếu các nghiên cứu trên cỡ mẫu lớn và trung tâm khác nhau [23]. Do đó, điện thế màng ty thể hiện mới được xem như một chỉ dấu tiềm năng, chưa đủ điều kiện trở thành thông số lâm sàng tiêu chuẩn. Cuối cùng, khả năng triển khai xét nghiệm điện thế màng ty thể trong thực hành còn bị hạn chế bởi yêu cầu thiết bị và nhân lực. Việc đánh giá điện thế màng ty thể chủ yếu dựa vào hệ thống Flow cytometry kết hợp thuốc nhuộm chuyên biệt, đòi hỏi chi phí đầu tư cao, cơ sở vật chất phù hợp và nhân sự được đào tạo. Những yêu cầu này làm giảm tính khả thi trong triển khai thường quy, đặc biệt tại các cơ sở hỗ trợ sinh sản có nguồn lực hạn chế.
Điện thế màng ty thể phản ánh khả năng tạo năng lượng của ty thể, cho thấy mối liên hệ với di động trong quá trình thụ tinh. Mặc dù các nghiên cứu hiện có chứng minh tiềm năng ứng dụng của chỉ số này trong đánh giá chức năng tinh trùng, việc triển khai lâm sàng vẫn còn hạn chế do chưa thống nhất về phương pháp đánh giá và ngưỡng phân tích giữa các nghiên cứu. Do vậy, các nghiên cứu trong tương lai cần tập trung chuẩn hoá quy trình định lượng và thiết lập giá trị tham chiếu lâm sàng, nhằm tạo cơ sở khoa học vững chắc để điện thế màng ty thể có thể ứng dụng trong thực hành hỗ trợ sinh sản.
Từ khóa: hiếm muộn, tinh trùng, điện thế màng ty thể.
-
Paoli, Donatella, et al. (2011), "Mitochondrial membrane potential profile and its correlation with increasing sperm motility", Fertility and sterility. 95(7), pp. 2315–2319.
-
Zorova, Ljubava D, et al. (2018), "Mitochondrial membrane potential", Analytical biochemistry. 552, pp. 50–59.
-
Alamo, Angela, et al. (2020), "Mitochondrial membrane potential predicts 4-hour sperm motility", Biomedicines. 8(7), p. 196.
-
Sukumar, Madhusudhanan, et al. "Mitochondrial membrane potential identifies cells with enhanced stemness for cellular therapy." Cell metabolism 23.1 (2016): 63-76.
-
Perera, Marianne R., et al. "A viral long non-coding RNA protects against cell death during human cytomegalovirus infection of CD14+ monocytes." Viruses 14.2 (2022): 246.
-
Madeja, Zofia E., et al. "Mitochondria content and activity are crucial parameters for bull sperm quality evaluation." Antioxidants 10.8 (2021): 1204.
-
McKinnon, Katherine M (2018), "Flow cytometry: an overview", Current protocols in immunology. 120(1), pp. 5.1. 1–5.1. 11.
-
Ling, Xi, et al. "Flow cytometric analysis of biomarkers for detecting human sperm functional defects." Journal of Visualized Experiments (JoVE) 182 (2022): e63790.
-
Biousse, Valérie, et al. "Long-term follow-up after unilateral intravitreal gene therapy for Leber hereditary optic neuropathy: the RESTORE study." Journal of Neuro-Ophthalmology 41.3 (2021): 309-315.
-
Blue, Elizabeth E., et al. "Dual diagnosis of UQCRFS1-related mitochondrial complex III deficiency and recessive GJA8-related cataracts." Rare 2 (2024): 100040.
-
Arena, Ignazio Giuseppe, et al. "Molecular genetics overview of primary mitochondrial myopathies." Journal of Clinical Medicine 11.3 (2022): 632.
-
Pitceathly, R. D., et al. (2013), “COX10 mutations resulting in complex multisystem mitochondrial disease that remains stable into adulthood”. JAMA neurology, 70(12), 1556-1561.
-
Costa, José, et al. (2023), "Mitochondria quality control and male fertility", Biology. 12(6), p. 827.
-
Elahi, Mahshid, et al. (2023), "Negative effect of varicocele on sperm mitochondrial dysfunction: A cross-sectional study", International Journal of Reproductive BioMedicine. 21(4), p. 323.
-
Sun, Tie Cheng, et al. "Bilateral varicocele leads to ferroptosis, pyroptosis and necroptosis of human spermatozoa and affects semen quality in infertile men." Frontiers in cell and developmental biology 11 (2023): 1091438.
-
Algieri, Cristina, et al. "Effects of cryopreservation on the mitochondrial bioenergetics of bovine sperm." Reproduction in Domestic Animals 58.1 (2023): 184-188.
-
O'connell, M., Neil Mcclure, and S. E. M. Lewis. "The effects of cryopreservation on sperm morphology, motility and mitochondrial function." Human reproduction 17.3 (2002): 704-709.
-
Meitei, Huidrom Yaiphaba, et al. "A simple, centrifugation-free, sperm-sorting device eliminates the risks of centrifugation in the Swim-up method while maintaining functional competence and DNA integrity of selected spermatozoa." Reproductive Sciences 28.1 (2021): 134-143.
-
Wang, Yutao, Xun Fu, and Hongjun Li. "Mechanisms of oxidative stress-induced sperm dysfunction." Frontiers in Endocrinology 16 (2025): 1520835.
-
Fang, Yi, et al. "Melatonin improves cryopreservation of ram sperm by inhibiting mitochondrial permeability transition pore opening." Reproduction in Domestic Animals 55.9 (2020): 1240-1249.
-
Condorelli, Rosita A., et al. "Myoinositol: does it improve sperm mitochondrial function and sperm motility?." Urology 79.6 (2012): 1290-1295.Arena, Ignazio Giuseppe, et al. "Molecular genetics overview of primary mitochondrial myopathies." Journal of Clinical Medicine 11.3 (2022): 632.
-
Alahmar, Ahmed T, et al. (2021), "Coenzyme Q10, oxidative stress, and male infertility: A review", Clinical and experimental reproductive medicine. 48(2), p. 97.
-
Marchetti, P., et al. "Influence of mitochondrial membrane potential of spermatozoa on in vitro fertilisation outcome." Andrologia 44.2 (2012): 136-141.