CN. Liên Mỹ Dinh – IVFMD SIH, Bệnh viện Phụ sản Quốc tế Sài Gòn
- TỔNG QUAN
Microfluidics (vi lưu) là một lĩnh vực khoa học điều khiển chất lỏng với thể tích cực nhỏ (nanolit-picolit) trong các vi kênh có kích thước micromet.1 Microfabrication (kỹ thuật chế tạo vi mô) là phương pháp sản xuất chuyên dụng nhằm tạo ra các cấu trúc và thiết bị phức tạp có kích thước siêu nhỏ, thường sử dụng các vật liệu như polymer (polydimethylsiloxane - PDMS), silicon và thủy tinh.2 Sự kết hợp hai công nghệ này tạo ra hệ thống “Lab-on-a-Chip” (LoC) - thiết bị thu nhỏ tích hợp nhiều chức năng phòng thí nghiệm trên một chip duy nhất.3
Trước đây, các chip LoC chủ yếu được chế tạo bằng phương pháp “quang khắc mềm” trên vật liệu PDMS. Tuy nhiên, phương pháp này bộc lộ nhiều hạn chế như chỉ tạo được cấu trúc 2,5D, độ phân giải thấp, và vật liệu PDMS tồn tại nhiều nhược điểm như sự hấp thụ các phân tử nhỏ, sự bốc hơi môi trường gây biến đổi áp suất thẩm thấu và khó khăn trong việc thu hồi mẫu.4 Để khắc phục, kỹ thuật “trùng hợp hai photon” (Two-Photon Polymerization - 2PP) đã ra đời, cho phép chế tạo các cấu trúc 3D phức tạp với độ phân giải vượt xa quang khắc mềm và khả năng sử dụng vật liệu tương thích sinh học bền vững hơn PDMS.5
Trong lĩnh vực hỗ trợ sinh sản (HTSS), kỹ thuật tiêm tinh trùng vào bào tương noãn (Intracytoplasmic Sperm Injection - ICSI) hiện chiếm tới 67% các chu kỳ thụ tinh ống nghiệm toàn cầu.6 Dù phổ biến, ICSI vẫn phụ thuộc lớn vào kỹ năng và kinh nghiệm của chuyên viên phôi học, dẫn đến sự thiếu ổn định trong kết quả do các biến số về thao tác tay.
Nhằm chuẩn hóa và hướng tới tự động hóa quy trình này, thiết bị microICSI đã được phát triển dựa trên nền tảng microfabrication. Bài viết này sẽ phân tích cấu trúc của thiết bị microICSI, quy trình vận hành và so sánh hiệu quả giữa microICSI với ICSI truyền thống (conventional ICSI - cICSI) để đánh giá tiềm năng ứng dụng của thiết bị này trong tương lai.
- THIẾT KẾ MỘT THIẾT BỊ MicroICSI
MicroICSI là một thiết bị tạo ra từ công nghệ 2PP, còn được gọi là “ghi laser trực tiếp” (direct laser writing). Sau khi in xong, thiết bị sẽ được xử lý hậu in và rửa theo các bước qua cồn và dung dịch đệm phosphate (Phosphate-Buffered Saline - PBS) nhằm loại bỏ nhựa thừa. Sau cùng, thiết bị sẽ được kiểm tra độc tính của từng bộ phận bằng thử nghiệm phôi chuột (Mouse Embryo Assay – MEA) để đảm bảo thiết bị không có độc tính gây độc cho tế bào.7
Thiết bị microICSI được thiết kế với mục tiêu cốt lõi là thay thế chức năng của kim giữ noãn (holding pipette) – đây thường là nguyên nhân gây nên stress cơ học lên noãn. Trong quy trình ICSI thông thường (cICSI), noãn được giữ cố định bằng lực hút âm thông qua kim giữ, điều này thường gây ra hiện tượng lõm màng noãn (oolemma invagination) quá mức và áp lực lên bào tương khi thực hiện tiêm tinh trùng.
Nghiên cứu ban đầu của Yagoub và cộng sự (2022) đã giới thiệu thiết bị MicroICSI gồm 2 thành phần là Pod và Garage. Pod (725x250x250mm) được thiết kế có dạng cốc (cup), là 1 khoang giúp giữ noãn ở vị trí trung tâm. Trên pod có 1 kênh dẫn hướng được thiết kế chính xác để kim tiêm có thể đi xuyên qua và tiếp cận noãn mà không cần kim giữ (holding pipette). Garage (1500x450x310mm) là bộ phận thiết kế dùng để chứa và quản lý nhiều Pod. Các Pod được xếp thành hàng trong Garage, cho phép thực hiện vi tiêm nhiều noãn cùng lúc. Toàn bộ hệ thống Pod và Garage có thể được đặt trong môi trường nuôi cấy, cho phép phôi phát triển ngay bên trong thiết bị sau tiêm (Hình 1).8
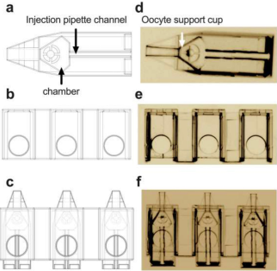
Hình 1: Hình 3D của Pod (a), Garage (b) và minh hoạ 3 Pods được gắn vào bên trong 1 Garage (c). Hình thực tế của Pod (d) và Garage (e) bằng phương pháp 2PP. Trong hình (c) và (f), 3 Pod được đặt gọn bên trong một Garage.
Trong nghiên cứu của McLennan và cộng sự (2024), thiết bị microICSI được thiết kế tối ưu hơn có thể chứa 20 noãn để thực hiện ICSI bên trong các vi giếng (microwell). Thiết kế của vi giếng đặc trưng gồm lòng giếng và đường cong hình bán cầu vừa khít với noãn có chức năng nhẹ nhàng cố định noãn giúp loại bỏ nhu cầu sử dụng kim giữ noãn trong quá trình ICSI (Hình 3b).9 Bên cạnh đó, thiết bị còn được thiết kế thêm các số nhỏ dưới đế giúp kiểm soát số lượng và thứ tự noãn đang tiêm (Hình 2).9 Đối diện đường cong hình bán cầu là khe hở cho kim ICSI di chuyển để đưa noãn vào vị trí bên trong bán cầu, xoay noãn để thể cực nằm ở vị trí 6h hoặc 12h và thực hiện tiêm tinh trùng vào bào tương noãn (Hình 3).9
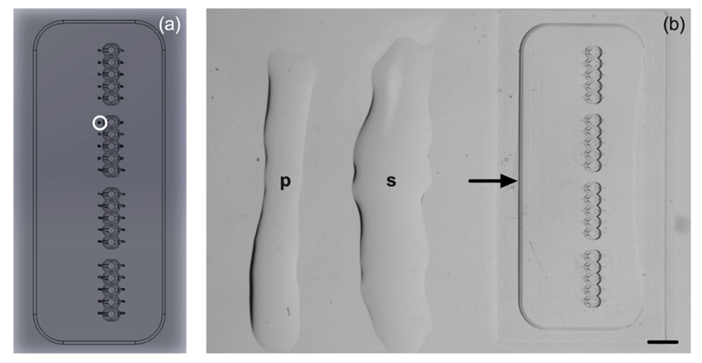
Hình 2: (2a) Bản vẽ thiết kế trên máy tính (the computer-aided design - CAD) của thiết bị microICSI với các số nhỏ được in cạnh mỗi vi giếng. (2b) thiết bị được đặt bên trong đĩa ICSI chứa môi trường nuôi cấy và phủ dầu “p”: giọt PVP 7% để bất động tinh trùng, “s”: giọt PVP 3,5% dùng để ủ tinh trùng và được đặt ngang từng microwell để tối ưu hoá quy trình di chuyển của kim ICSI.
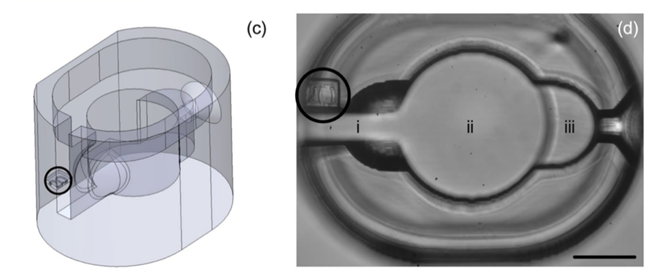
Hình 3: (3c) Góc nghiêng 3D của thiết bị. (3d) Chi tiết một microwell gồm 3 thành phần: (i) Khe cắm kim ICSI (Injection pipette slot) nhằm định hướng kim ICSI đi vào đúng vị trí. (ii) Vi giếng (Microwell) giữ noãn cố định mà không cần kim holding, (iii) Bán cầu tiêm (Injection hemisphere) hỗ trợ giữ noãn giúp việc đưa kim ICSI qua màng noãn một cách ổn định nhất.
- ĐÁNH GIÁ AN TOÀN VÀ TƯƠNG THÍCH SINH HỌC
Thử nghiệm phôi chuột (MEA) và phát triển tiền làm tổ
Yagoub (2022) đã thực hiện một nghiên cứu mô phỏng quá trình ICSI để so sánh ICSI thông thường (cICSI) và ICSI trên thiết bị microICSI sử dụng hợp tử chuột giả định (Presumptive Zygotes - PZs) được tiêm vi hạt huỳnh quang. Hợp tử chuột giả định là những hợp tử chuột thu được từ bóng vòi trứng của chuột cái sau khi cho chuột cái giao phối với chuột đực qua đêm. PZs sẽ được tiêm vi hạt huỳnh quang có kích thước mô phỏng kích thước đầu tinh trùng để có thể chứng minh khả năng ICSI trên noãn người của thiết bị microICSI (vì đường kính đầu của tinh trùng chuột là 7,9mm khác với đường kính đầu tinh trùng người chỉ 4,5mm). Các PZs này được nuôi tới giai đoạn phôi nang và việc nuôi thành công có thể được chứng minh thông qua sự quan sát các vi hạt huỳnh quang bên trong PZs và sự hiện diện liên tục của chúng trong các phôi nang được tạo thành. Kết quả đánh giá độc tính của Pod và Garage của nghiên cứu cho thấy so với nuôi cấy tiêu chuẩn, tiêm và nuôi cấy phôi trong Pod và Garage không cho thấy sự khác biệt về sự phát triển đến giai đoạn phôi nang hoặc mức độ tổn thương DNA trong các phôi nang tạo thành. Hình thái của các phôi nang phát triển trong thiết bị microICSI hoàn toàn bình thường, với sự biệt hóa rõ rệt của khối tế bào bên trong (inner cell mass) và lớp lá nuôi phôi (trophectoderm).8
Tính toàn vẹn của DNA và stress tế bào
Một trong những ưu điểm nổi bật của microICSI là việc giảm thiểu stress vật lý. Phân tích hóa mô miễn dịch đối với kháng thể γH2A.X (một dấu hiệu của sự đứt gãy sợi đôi DNA) trên phôi nang chuột cho thấy mức độ tổn thương DNA trong nhóm sử dụng thiết bị 2PP không khác biệt so với nhóm đối chứng. Điều này khẳng định rằng cả vật liệu nhựa nhạy quang và quy trình xử lý hậu in (rửa bằng cồn và PBS) đều an toàn tuyệt đối cho các tế bào mầm nhạy cảm.8
- HIỆU QUẢ VÀ KẾT CỤC PHÔI HỌC GIỮA MICROICSI VÀ C.ICSI
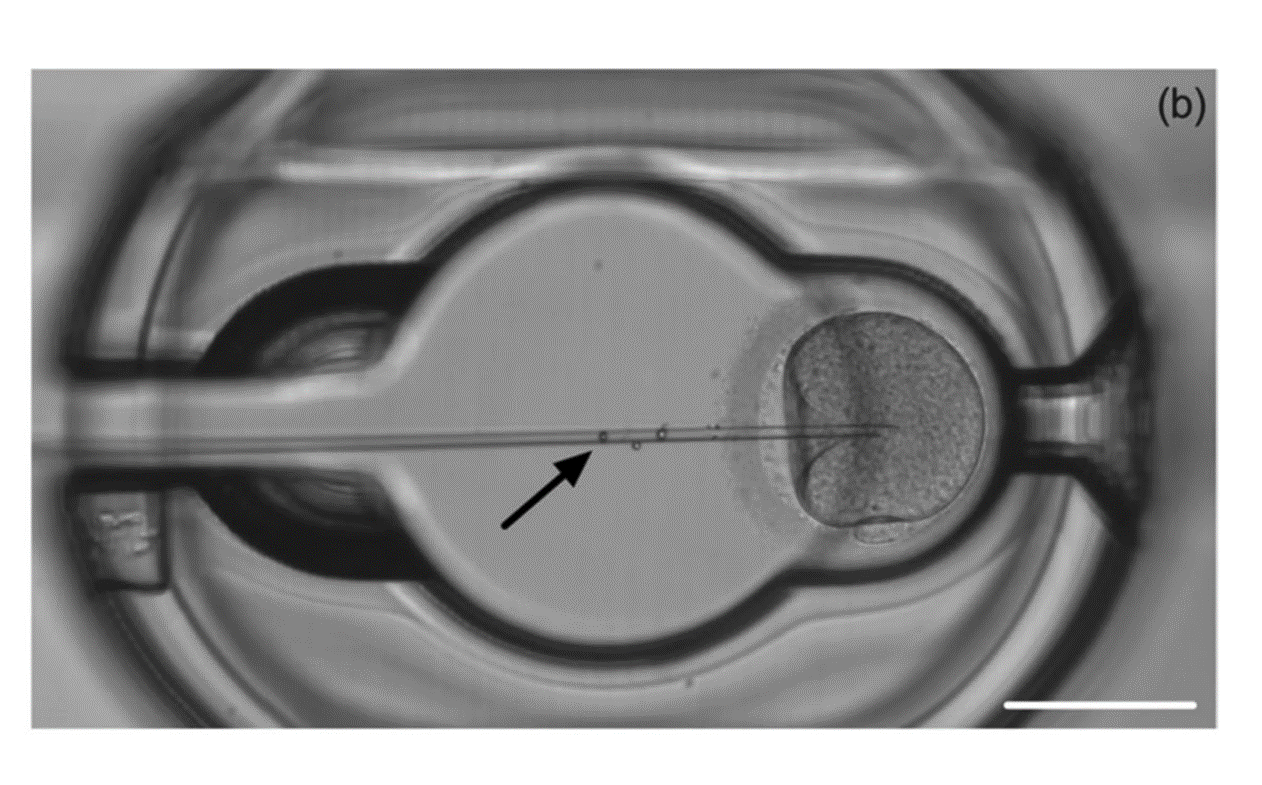
Năm 2024, McLennan và cộng sự đã thiết kế một nghiên cứu nhằm so sánh cICSI và microICSI trên đối tượng là noãn lợn và noãn người bị loại bỏ.9 Thí nghiệm có 2 giai đoạn. Ở giai đoạn 1, tác giả đã thực hiện ICSI trên noãn lợn bằng 2 phương pháp và so sánh. Noãn sau khi loại bỏ lớp cumulus sẽ được tiến hành ICSI bằng cả 2 phương pháp là cICSI và microICSI (Hình 4). Kết quả của giai đoạn 1 cho thấy thời gian chuẩn bị đĩa là tương đương giữa cICSI và microICSI. Trong khi đó, thời gian để gắn kim, thao tác, điều chỉnh thể cực và tiêm đều giảm khi sử dụng microICSI so với cICSI vì đã loại bỏ kim holding trong toàn bộ quy trình. Số lần điều chỉnh tay để điều khiển các bộ phận vi thao tác cũng giảm 2/3 lần với microICSI. Đối với đánh giá mức độ tác động đến noãn và phôi, nghiên cứu cho thấy mức độ tạo phễu, tỷ lệ thất bại khi tiêm, tỷ lệ thụ tinh, chất lượng phôi nang là tương đương ở 2 nhóm cICSI và microICSI, trong khi đó, tỉ lệ phát triển lên phôi nang tăng đáng kể ở nhóm microICSI (21,1%) so với nhóm cICSI (13,5%). Tác giả giải thích nguyên nhân do microICSI đã làm giảm tổn thương vật lý ở màng noãn và rút ngắn thời gian noãn ở bên ngoài môi trường. Giai đoạn 2 của nghiên cứu thực hiện tiêm vi hạt vào noãn người và tiêm mỗi noãn 2 lần nhằm đánh giá tính khả thi và hiệu suất thao tác của thiết bị microICSI trên noãn người. Kết quả cho thấy thiết bị microICSI phù hợp để vi tiêm trên noãn người: thời gian tiêm, số lần điều chỉnh tay giảm đáng kể với microICSI so với cICSI trên noãn người.
Một nghiên cứu mới nhất của Satoh và cộng sự (2025) trên noãn người so sánh giữa 2 nhóm thực hiện c.ICSI (n=52) và microICSI (n=54) cũng đem lại kết quả hoàn toàn khả quan, trong đó, tỉ lệ thụ tinh (bao gồm thụ tinh bất thường) cao hơn ở nhóm microICSI (80% so với 73%) và tỷ lệ thụ tinh bình thường (2PN) là tương đương giữa 2 nhóm. Tỷ lệ thoái hoá noãn sau tiêm có xu hướng thấp hơn ở nhóm sử dụng microICSI so với cICSI (3% so với 10%). Nhìn chung, kết quả không có sự khác biệt có ý nghĩa thống kê về tỷ lệ thụ tinh và tỷ lệ thoái hoá giữa 2 phương pháp. Tác giả cho rằng cỡ mẫu của nghiên cứu còn nhỏ cùng với việc nghiên cứu sử dụng noãn MII trưởng thành muộn (noãn non ban đầu, xuất hiện thể cực thứ nhất sau 24 - 48h sau chọc hút) được thuỷ tinh hoá-rã đông nên có thể sẽ không phản ánh chính xác những gì xảy ra với noãn trưởng thành đúng hạn.10
Từ các nghiên cứu trên có thể thấy việc sử dụng thiết bị microICSI giúp đơn giản hóa quy trình (chỉ cần một bên vi thao tác) và làm cho thao tác tiêm tuần tự nhanh hơn gấp 2,5 lần so với ICSI thông thường. Điều này giúp tăng hiệu suất phòng lab như giảm thời gian gắn kim, thời gian “load” noãn (có thể ICSI 20 noãn một lúc), thời gian thực hiện quy trình trung bình cho mỗi noãn, và quan trọng nhất là giảm số lần điều chỉnh bằng tay cần thiết. Việc này cũng giúp giảm bớt yêu cầu về kinh nghiệm đối với chuyên viên phôi học vận hành quy trình, song song đó, microICSI cũng có thể đem lại kết cục phôi học tích cực hơn so với cICSI.

Hình 4: Noãn lợn được thực hiện ICSI bằng 2 phương pháp là cICSI (a) và sử dụng thiết bị microICSI (b)
- KHẢ NĂNG ỨNG DỤNG VÀ HƯỚNG PHÁT TRIỂN TƯƠNG LAI
Các nghiên cứu về thiết bị microICSI đã so sánh chúng với cICSI trên mô hình noãn lợn, chuột, noãn bị loại bỏ ở người (chỉ tiêm vi hạt giả định) và noãn người trưởng thành muộn được đông lạnh-rã đông cũng đã gợi ý về những hiệu quả mà microICSI đem lại nhằm cải thiện quy trình ICSI. Thêm vào đó, thời gian đào tạo ICSI cần thiết để các chuyên viên phôi học thực tập cách sử dụng microICSI sẽ được giảm bớt. Điều này, khi kết hợp với rút ngắn thời gian thực hiện quy trình do đã loại bỏ việc gắn kim holding, sẽ tạo ra những tác động giúp giảm bớt khối lượng công việc cho chuyên viên phôi học và giảm tình trạng thiếu hụt chuyên viên phôi học. Hơn nữa, việc giảm bớt khối lượng công việc ICSI có khả năng hỗ trợ làm giảm bớt các rối loạn cơ xương khớp- vốn là vấn đề sức khoẻ nghề nghiệp phổ biến nhất đang ảnh hưởng đến các chuyên viên phôi học. Tuy nhiên các nghiên cứu này còn tồn tại nhiều nhược điểm như sử dụng noãn động vật hoặc noãn người đã bị loại bỏ có khả năng sẽ không tương đương khi so sánh với noãn người, và cỡ mẫu nhỏ. Vì thế, cần có thêm các nghiên cứu ngẫu nhiên có nhóm chứng (Randomized controlled clinical trials – RCTs) với quy mô rộng hơn để có thể cung cấp dữ liệu tin cậy nhằm phân tích và đánh giá đầy đủ các lợi ích của microICSI so với ICSI thông thường.9,10
Việc sử dụng đĩa chích ICSI thương mại có nhược điểm là khi đặt thiết bị microICSI và “load” noãn vào thì noãn sẽ nằm cao hơn hẳn so với mặt phẳng của các giọt tinh trùng ở đáy đĩa dẫn đến việc phải nâng kim ICSI lên nhiều sau khi bắt tinh trùng để có thể tiếp cận được noãn trong thiết bị. Do đó McLennan đã đề xuất đĩa chích ICSI nên được thiết kế riêng có vị trí lõm ở đáy đĩa đặt vừa khít thiết bị microICSI để từ đó noãn và giọt tinh trùng có thể nằm ở đáy đĩa chung mặt phẳng. Bên cạnh đó, microICSI có thể ứng dụng trong tạo ra Robotic ICSI, tự động hoá quy trình ICSI hoặc kết hợp giữa microICSI và Piezo ICSI (sử dụng thiết bị tạo ra xung rung động kết hợp với kim Piezo ICSI đầu bằng, rất mỏng để giúp kim tiêm xuyên qua màng noãn một cách nhẹ nhàng hơn so với cICSI) để có thể cải thiện hơn nữa kết cục của ICSI.9
- KẾT LUẬN
Tóm lại, microICSI là thiết bị được chế tạo từ công nghệ trùng hợp hai photon và được xem là một giải pháp tiềm năng giúp tối ưu hóa kỹ thuật tiêm tinh trùng vào bào tương noãn. Nhờ thiết kế hệ thống vi giếng (microwell) và cấu trúc bán cầu cố định mẫu nhẹ nhàng, thiết bị này đã loại bỏ hoàn toàn nhu cầu sử dụng kim giữ noãn, từ đó giảm thiểu lực hút âm và các tác động cơ học gây căng thẳng lên noãn. Các kết quả nghiên cứu thực nghiệm cho thấy microICSI không chỉ đảm bảo an toàn tuyệt đối cho phôi khi vượt qua các xét nghiệm độc tính MEA, mà còn giúp rút ngắn đáng kể thời gian thao tác và giảm tới 2/3 số lần điều chỉnh tay của chuyên viên phôi học so với phương pháp cICSI truyền thống. Đặc biệt, thiết bị có tỷ lệ thụ tinh và phát triển phôi nang tương đương, thậm chí có xu hướng cải thiện kết cục phôi học trong một số nghiên cứu. Tuy nhiên, các nghiên cứu hiện tại chỉ mới dừng ở các nghiên cứu quy mô nhỏ hoặc trên mô hình động vật, vì thế nên, cần thêm các nghiên cứu trong tương lai để có thể ứng dụng thiết bị này trong thực hiện tiêm tinh trùng vào bào tương noãn ở noãn người.
TLTK:
1. Smith GD, Takayama S. Application of microfluidic technologies to human assisted reproduction. Mol Hum Reprod. 2017;23(4):257-268. doi:10.1093/molehr/gaw076
2. Qin D, Xia Y, Whitesides GM. Soft lithography for micro- and nanoscale patterning. Nat Protoc. 2010;5(3):491-502. doi:10.1038/nprot.2009.234
3. Goss DM, Vasilescu SA, Warkiani ME, Thompson JG, Gardner DK. How Microfluidics and Microfabrication Will Improve Diagnosis and Treatment in Human Art. In: Textbook of Assisted Reproductive Techniques. 6th ed. CRC Press; 2023.
4. Gharib G, Bütün İ, Muganlı Z, et al. Biomedical Applications of Microfluidic Devices: A Review. Biosensors. 2022;12(11):1023. doi:10.3390/bios12111023
5. Gardner DK, Weissman A, Howles CM, Shoham Z, eds. Textbook of Assisted Reproductive Techniques: Volume 1: Laboratory Perspectives. 6th ed. CRC Press; 2023. doi:10.1201/9781003268598
6. Banker M, Dyer S, Chambers GM, et al. International Committee for Monitoring Assisted Reproductive Technologies (ICMART): world report on assisted reproductive technologies, 2013. Fertil Steril. 2021;116(3):741-756. doi:10.1016/j.fertnstert.2021.03.039
7. McLennan HJ, Blanch AJ, Wallace SJ, et al. Nano-liter perfusion microfluidic device made entirely by two-photon polymerization for dynamic cell culture with easy cell recovery. Sci Rep. 2023;13(1):562. doi:10.1038/s41598-023-27660-x
8. Yagoub SH, Thompson JG, Orth A, Dholakia K, Gibson BC, Dunning KR. Fabrication on the microscale: a two-photon polymerized device for oocyte microinjection. J Assist Reprod Genet. 2022;39(7):1503-1513. doi:10.1007/s10815-022-02485-1
9. McLennan HJ, Heinrich SL, Inge MP, et al. A micro-fabricated device (microICSI) improves porcine blastocyst development and procedural efficiency for both porcine intracytoplasmic sperm injection and human microinjection. J Assist Reprod Genet. 2024;41(2):297-309. doi:10.1007/s10815-023-03018-0
10. Satoh M, Miyamoto Y, Takakado C, Watabe M, Tarui S, Morimoto Y. P-247 Equivalence observed in fertilisation rates between microICSI, a new ICSI tool, and conventional ICSI. The first evaluation of microICSI fertilisation of human oocytes. Hum Reprod. 2025;40(Supplement_1):deaf097.555. doi:10.1093/humrep/deaf097.555