CN. Đinh Thị Ngọc Ánh, CN. Lê Thị Bích Liên
Bệnh viện Đa khoa Gia Đình, Đà Nẵng
-
GIỚI THIỆU
Microbiome, hay hệ vi sinh vật được định nghĩa là vật liệu di truyền của vi sinh vật cư trú trong cơ thể người cùng với các sản phẩm chuyển hóa và môi trường xung quanh [1]. Trong đó, hệ vi sinh âm đạo (Vaginal microbiome – VM) là một hệ sinh thái phức tạp và đa dạng gồm các vi sinh vật cộng sinh, tương hỗ và cả các tác nhân tiềm ẩn gây bệnh cư trú trên niêm mạc và trong âm đạo. Thành phần và tính ổn định của VM chịu tác động bởi nhiều yếu tố như chủng tộc, tuổi, nội tiết tố, chu kỳ kinh nguyệt, hành vi – lối sống, chế độ dinh dưỡng và hoạt động tình dục. Hệ vi sinh vật trong âm đạo và tử cung đóng vai trò thiết yếu trong duy trì cân bằng sinh lý, điều hòa miễn dịch và hỗ trợ chức năng sinh sản. Đặc biệt, hormone steroid (Estrogen và Progesterone) là những yếu tố điều hòa trung tâm của hệ sinh sản ở nữ. Sự mất cân bằng giữa nội tiết tố và hệ vi sinh vật có thể dẫn đến các rối loạn sinh sản như viêm âm đạo, sẩy thai sớm, thất bại làm tổ hoặc sinh non [2]. Bài viết sẽ phân tích sự tương tác giữa hormone steroid và hệ vi sinh vật âm đạo - tử cung có ý nghĩa quan trọng trong sức khoẻ sinh sản và kết cục trong hỗ trợ sinh sản (HTSS).
-
HỆ VI SINH VẬT ÂM ĐẠO VÀ TỬ CUNG
Hệ vi sinh vật âm đạo khoẻ mạnh đặc trưng bởi sự chiếm ưu thế của các loài Lactobacillus. Theo đó, ở những người phụ nữ khoẻ mạnh, hệ vi sinh vật trong âm đạo được chi phối bởi các loài Lactobacillus và có thể được phân loại thành năm kiểu trạng thái khuẩn hệ (Community State Types – CSTs) cụ thể: CST I (do L.crispatus chiếm ưu thế), CST II (do L. gasseri chiếm ưu thế), CST III (do L. iners chiếm ưu thế), CST IV (với các loại vi khuẩn khác như vi khuẩn kỵ khí chiếm ưu thế) và CTS V (do L.jensenii chiếm ưu thế). Trong đó, CST I duy trì môi trường âm đạo khoẻ mạnh, nồng độ pH thấp và khả năng chống lại các tác nhân gây bệnh. Ngược lại, CST III thường kém ổn định và dễ viêm hay nhiễm khuẩn. Các CST II và V ít phổ biến hơn, trong khi CST IV là một kiểu đa dạng vi sinh vật với sự hiện diện chủ yếu của các vi khuẩn kỵ khí như Prevotella, Dialister, Atopobium, Gardnerella và Sneathia…không được chi phối bởi các loài Lactobacillus. CTS IV đặc trưng bởi độ pH âm đạo cao hơn đáng kể (> 4,5) và gia tăng nguy cơ mắc các bệnh phụ khoa [3–5].
Trước đây, cổ tử cung được cho là tiếp nối trực tiếp với hệ vi sinh vật âm đạo, tuy nhiên các bằng chứng hiện nay cho thấy có sự khác biệt đáng kể giữa hai hệ vi sinh vật này. Tại cổ tử cung, Firmicutes chiếm ưu thế, đặc biệt Lactobacillus chiếm hơn 80,2% trong tổng vi sinh vật [3]. Theo Keburiya và cộng sự (2022) ghi nhận L. crispatus trong cổ tử cung sản xuất acid lactic và các hợp chất kháng khuẩn, giúp chống lại sự xâm nhập của tác nhân gây bệnh và giảm nguy cơ nhiễm HPV (Human Papillomavirus) [6]. Bacteroidetes là ngành phổ biến thứ hai, trong đó Prevotella có liên quan đến tổn thương cổ tử cung thông qua hoạt hóa trục tín hiệu NF-κB/C-myc trong nhiễm HPV. Ngoài ra, các chi như Gardnerella và Sneathia thuộc các ngành Actinobacteria và Fusobacteria cũng được ghi nhận ở phụ nữ nhiễm HPV nguy cơ cao [3].
Nhiều năm trước đây, nội mạc tử cung (NMTC) được xem là môi trường vô khuẩn. Tuy nhiên, các kỹ thuật phân tử hiện đại đã chứng minh sự tồn tại của một hệ vi sinh vật với mật độ thấp cư trú tại NMTC [7]. Hiện nay, chưa có sự đồng thuận về hệ vi sinh vật cốt lõi trong NMTC ở phụ nữ khoẻ mạnh, nhưng Lactobacillus vẫn chiếm ưu thế, từ đó cho thấy sự liên tục của hệ vi sinh vật dọc theo đường sinh dục nữ. Bên cạnh đó, các vi khuẩn khác như Streptococcus, Gardnerella, Prevotella, Bifidobacterium…cũng được ghi nhận ở NMTC với mức độ thay đổi tuỳ nghiên cứu [3].
-
SỰ TƯƠNG TÁC GIỮA HORMONE VÀ MICROBIOME
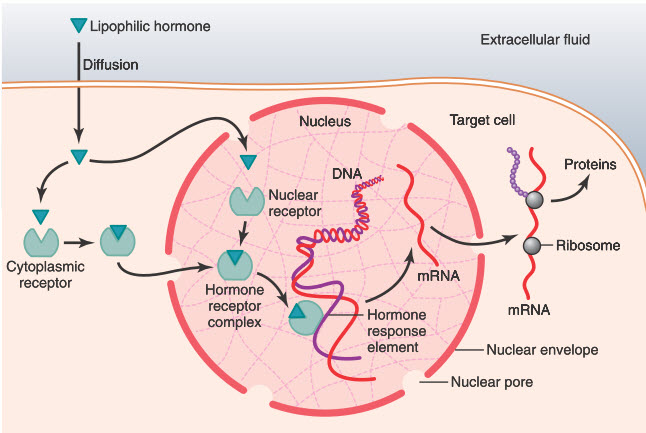
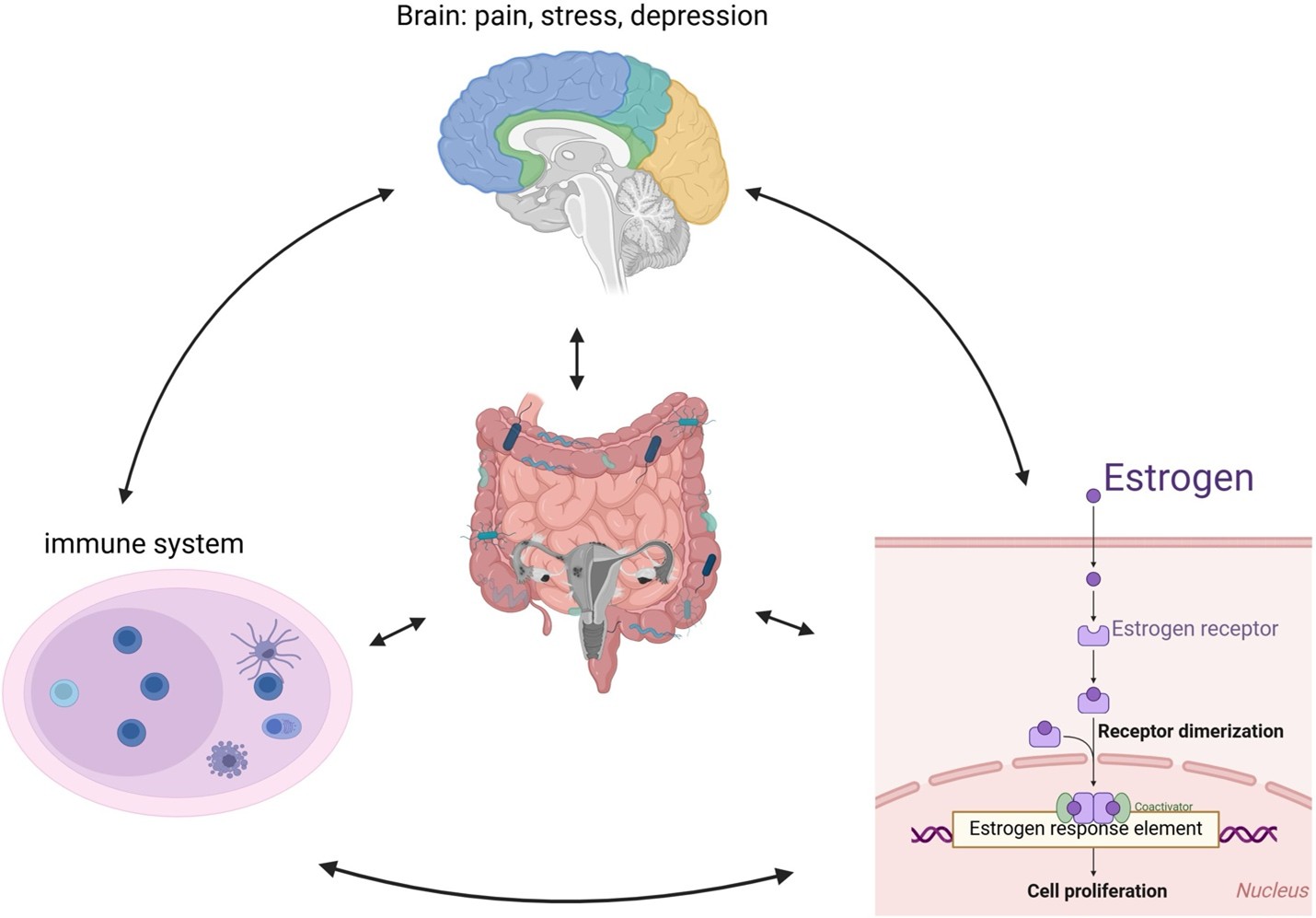
Sự tương tác giữa hormone sinh dục đặc biệt là estrogen và progesterone và hệ vi sinh vật ở âm đạo – tử cung là một quá trình song phương và rất quan trọng để duy trì sức khoẻ sinh sản của phụ nữ. Dưới tác động của estrogen và progesterone, glycogen từ biểu mô âm đạo được giải phóng và chuyển hóa nhờ Lactobacillus thành các đường đơn, tạo ra nhiều sản phẩm chuyển hoá, đặc biệt là lactate. Lượng acid lactic tạo ra duy trì môi trường âm đạo có tính acid (pH ~ 3,8 - 4,0), từ đó ức chế sự phát triển của các vi khuẩn gây bệnh. Bên cạnh vai trò điều hoà pH, acid lactic còn tham gia vào quá trình ức chế histone deacetylase, thúc đẩy phiên mã gen, hỗ trợ sửa chữa DNA và đồng thời kích thích quá trình tự thực bào ở các tế bào biểu mô và thúc đẩy cân bằng nội môi biểu mô. Đặc biệt, acid lactic còn có khả năng ức chế các vi sinh vật liên quan đến viêm âm đạo do vi khuẩn nhưng không bị ức chế bởi hydrogen peroxide (H₂O₂) [8].
Ở phụ nữ trong độ tuổi sinh sản, nồng độ estrogen dao động theo chu kỳ kinh nguyệt: tăng dần trong pha nang noãn, đạt đỉnh vào thời điểm rụng trứng và giảm ở pha hoàng thể. Những biến động này làm thay đổi liên tục môi trường âm đạo. Nồng độ estrogen cao thúc đẩy tích luỹ glycogen trong biểu mô âm đạo, tạo điều kiện thuận lợi cho sự phát triển của các loài Lactobacillus lên men acid lactic, nhờ đó duy trì tính ổn định và pH thấp đặc trưng. Ngược lại, khi nồng độ estrogen suy giảm ở giai đoạn tiền mãn kinh, đặc biệt sau mãn kinh, tỷ lệ Lactobacillus giảm rõ rệt, pH âm đạo chuyển từ acid sang trung tính và các loại vi khuẩn kỵ khí như Gardnerella, Prevotella và Atopobium có cơ hội chiếm ưu thế [8]. Một số bằng chứng ghi nhân hệ vi sinh vật trong tử cung cũng có thể chịu tác động của các biến đổi hormone theo chu kỳ kinh nguyệt [9].
Trong thai kỳ, sự gia tăng mạnh của estrogen và progesterone tạo điều kiện lý tưởng cho sự phát triển của phôi và đồng thời tái định hình hệ vi sinh vật. Hệ vi sinh vật bình thường thay đổi theo từng tam cá nguyệt. Khi thai kỳ phát triển, sự đa dạng vi sinh thường giảm, nhưng Lactobacillus lại tăng, góp phần củng cố hàng rào bảo vệ âm đạo. Tuy nhiên, các dữ liệu vẫn còn nhiều tranh cãi. Bên cạnh đó, ngày càng có nhiều bằng chứng cho thấy tử cung và ống dẫn trứng không hoàn toàn vô khuẩn và hệ vi sinh vật tại đây có thể liên quan đến sức khoẻ thai nhi. Sau sinh, nồng độ estrogen và progesterone sẽ trở lại giá trí như trước khi mang thai trong khoảng năm ngày và hệ vi sinh vật ít bị Lactobacillus chi phối hơn và sự đa dạng alpha tăng lên, phản ánh sự thay đổi sinh lý sau sinh [10]
-
TÁC ĐỘNG LÂM SÀNG TRONG Y HỌC SINH SẢN
Trong những năm gần đây, hệ vi sinh vật âm đạo – tử cung được ghi nhận có vai trò quan trọng ảnh hưởng đến khả năng sinh sản của người phụ nữ. Theo đó, ở những người phụ nữ khoẻ mạnh, Lactobacillus chiếm ưu thế giúp duy trì acid âm đạo và như là “hàng rào bảo vệ” chống lại các tác nhân gây bệnh.
Trong điều trị hỗ trợ sinh sản (HTSS), hệ vi sinh vật âm đạo, cổ tử cung và NMTC đóng vai trò quan trọng trong quá trình làm tổ và sự phát triển của thai. Ba nghiên cứu đoàn hệ tiến cứu được thực hiện nhằm phân tích ảnh hưởng của hệ vi sinh vật NMTC lên kết cục thai kỳ ở nhóm phụ nữ điều trị thụ tinh trung ống nghiệm. Kết quả nghiên cứu cho thấy sự hiện diện của một hệ vi sinh vật không được chiếm ưu thế bởi Lactobacillus có liên quan đến sự giảm sút đáng kể khả năng làm tổ (60,7% so với 23,1%; p=0,02), cũng như tỷ lệ thai lâm sàng, thai diễn tiến và tỷ lệ trẻ sinh sống [11]. Trong chu kỳ IVF/ICSI, các thay đổi nội tiết trong quá trình kích thích buồng trứng hoặc can thiệp thủ thuật cũng có thể làm thay đổi cấu trúc hệ vi sinh vật, làm giảm ưu thế Lactobacillus và tạo điều kiện cho vi khuẩn cơ hội phát triển. Nhằm cải thiện khả năng dự đoán kết quả điều trị, các kỹ thuật đánh giá vi sinh vật như 16S rRNA sequencing, metagenomic analysis và real-time PCR được sử dụng ngày càng phổ biến. Trong đó, PCR có độ nhạy cao đối với các vi khuẩn đặc hiệu, trong khi giải trình tự gen thế hệ mới cung cấp cái nhìn toàn diện về hệ vi sinh vật. Mặc dù chưa trở thành quy trình thường quy trong lĩnh vực HTSS nhưng các kỹ thuật này cho thấy tiềm năng ứng dụng đáng kể trong lựa chọn thời điểm chuyển phôi, cá thể hóa điều trị và đánh giá nguy cơ thất bại làm tổ. Tuy nhiên, chi phí cao, yêu cầu thiết bị chuyên biệt và tiêu chuẩn hóa vẫn là những rào cản lớn [12].
-
HƯỚNG NGHIÊN CỨU TƯƠNG LAI
Môi trường âm đạo là một hệ sinh thái động và phức tạp, trong đó hệ vi sinh liên tục tương tác với vật chủ dưới sự tác động bởi các yếu tố sinh học như hormone steroid, tính toàn vẹn của hàng rào niêm mạc và nguồn dinh dưỡng. Trong khi trước đây, các nghiên cứu tập trung chủ yếu mô tả hệ vi sinh, xác định thành phần và mối tương quan của chúng với tình trạng lâm sàng, thì các công trình nghiên cứu gần đây bắt đầu mở rộng sang giải mã các cơ chế phân tử và chức năng tương tác giữa hệ vi sinh vật và vật chủ nhằm giúp chẩn đoán và can thiệp trong lâm sàng. Tuy nhiên, nhiều vấn đề trọng tâm cho đến hiện nay vẫn còn bỏ ngỏ như: (i) yếu tố nào thực sự thay đổi hệ vi sinh – liệu vật chủ điều chỉnh chất dinh dưỡng để chọn lọc vi sinh vật hay chính quá trình chuyển hoá của vi sinh thúc đẩy sự thay đổi môi trường?; (ii) làm rõ định nghĩa “sức khoẻ âm đạo” – dựa trên thành phần vi sinh hay dựa trên biểu hiện triệu chứng?; (iii) ý nghĩa và ngưỡng xác định của “vi sinh vật chiếm ưu thế”; (iv) vai trò của các loài có tỷ lệ thấp nhưng vẫn tồn tại dai dẳng; và (v) đóng góp của các nhóm vi sinh thường bị bỏ quên như virus, vi khuẩn cổ, nấm và thực khuẩn thể. Sự phát triển của các mô hình in-vitro như mô hình “on-a-chip” và các nghiên cứu về sự biến thiên của hệ vi sinh vật dựa trên timelapse thay vì chỉ dựa vào dữ liệu tại một thời điểm mở ra cái nhìn động học và chính xác hơn về hệ vi sinh đường sinh dục [13].
Bên cạnh đó, phạm vi nghiên cứu cần mở rộng không chỉ giới hạn ở nhóm phụ nữ trong độ tuổi sinh sản mà còn bao gồm nhóm phụ nữ sau sinh, tiền mãn kinh, mãn kinh, sau mãn kinh và người chuyển giới – những nhóm có nguy cơ thay đổi hệ vi sinh nhưng thường bị loại trừ khỏi các nghiên cứu [13].
Những dữ liệu hiện nay về tương tác giữa hormone steroid và hệ vi sinh vật mở ra nhiều hướng điều trị tiềm năng. Một trong số đó là sử dụng probiotic nhằm phục hồi hệ vi sinh ưu thế Lactobacillus giúp giảm viêm âm đạo và cải thiện tình trạng viêm NMTC. Bên cạnh đó, kỹ thuật ghép hệ vi sinh âm đạo đã cho thấy khả năng tái thiết lập môi trường vi sinh khỏe mạnh ở những phụ nữ bị rối loạn vi khuẩn nặng hoặc viêm âm đạo tái diễn. Điều chỉnh nội tiết cũng là một hướng tiếp cận quan trọng nhằm hỗ trợ duy trì môi trường âm đạo – tử cung giàu Lactobacillus, đặc biệt trong các chu kỳ chuẩn bị nội mạc. Ngoài ra, việc xem hệ vi sinh vật như một biomarker giúp đánh giá khả năng tiếp nhận phôi và dự đoán nguy cơ thất bại trong chu kỳ IVF/ICSI cũng là xu hướng mới trong y học sinh sản [14].
Song song với lĩnh vực HTSS, hiểu biết về hệ vi sinh vật cũng mở ra tiềm năng cải thiện chẩn đoán và điều trị trong ung thư phụ khoa. Trong ung thư NMTC, phẫu thuật cắt bỏ tử cung vẫn là lựa chọn điều trị chuẩn nhưng lại làm mất khả năng sinh sản của người phụ nữ, do đó việc phát triển các công cụ chẩn đoán sớm dựa trên hệ vi sinh vật có thể giúp xác định chiến lược điều trị thay thế như liệu pháp nội tiết và điều chỉnh hệ vi sinh vật nhằm bảo tồn tử cung [15]. Trong liệu pháp miễn dịch, đa dạng hệ vi sinh vật và các chất chuyển hóa có thể điều hoà các điểm kiểm soát miễn dịch, như chất ức chế hoạt hóa tế bào T của immunoglobulin có miền V (VISTA -V-domain immunoglobulin suppressor of T cell activation), và thúc đẩy thâm nhập tế bào T vào mô bệnh, từ đó cải thiện hiệu quả điều trị [16].
VI. KẾT LUẬN
Sự tương tác giữa các hormone steroid và hệ vi sinh vật âm đạo - tử cung tạo nên một trục điều hòa hai chiều có ý nghĩa sinh lý học quan trọng, tác động trực tiếp đến sức khỏe sinh sản nữ và hiệu quả của các kỹ thuật hỗ trợ sinh sản. Các bằng chứng tích lũy hiện nay cho thấy các hormone sinh dục không chỉ điều khiển thành phần và hoạt động của hệ vi sinh vật mà chính chúng cũng có khả năng đáp ứng nội tiết và miễn dịch của đường sinh sản. Sự phối hợp này ảnh hưởng trực tiếp đến quá trình làm tổ, phát triển phôi và khả năng duy trì thai kỳ, đồng thời tác động đến hiệu quả của các kỹ thuật hỗ trợ sinh sản.
Tài liệu tham khảo:
1. Marchesi, J. R., & Ravel, J. (2015). The vocabulary of microbiome research: A proposal. Microbiome, 3(1), 31. https://doi.org/10.1186/s40168-015-0094-5
2. Osei Sekyere, J., Oyenihi, A. B., Trama, J., & Adelson, M. E. (2023). Species-Specific Analysis of Bacterial Vaginosis-Associated Bacteria. Microbiology Spectrum, 11(4), e04676-22. https://doi.org/10.1128/spectrum.04676-22
3. Gao, H., Liu, Q., Wang, X., Li, T., Li, H., Li, G., Tan, L., & Chen, Y. (2024). Deciphering the role of female reproductive tract microbiome in reproductive health: A review. Frontiers in Cellular and Infection Microbiology, 14, 1351540. https://doi.org/10.3389/fcimb.2024.1351540
4. France, M. T., Ma, B., Gajer, P., Brown, S., Humphrys, M. S., Holm, J. B., Waetjen, L. E., Brotman, R. M., & Ravel, J. (2020). VALENCIA: A nearest centroid classification method for vaginal microbial communities based on composition. Microbiome, 8, 166. https://doi.org/10.1186/s40168-020-00934-6
5. Shen, L., Zhang, W., Yuan, Y., Zhu, W., & Shang, A. (2022). Vaginal microecological characteristics of women in different physiological and pathological period. Frontiers in Cellular and Infection Microbiology, 12, 959793. https://doi.org/10.3389/fcimb.2022.959793
6. Keburiya, L. K., Smolnikova, V. Yu., Priputnevich, T. V., Muravieva, V. V., Gordeev, A. B., Trofimov, D. Yu., Shubina, E. S., Kochetkova, T. O., Rogacheva, M. S., Kalinina, E. A., & Sukhikh, G. T. (2022). Does the uterine microbiota affect the reproductive outcomes in women with recurrent implantation failures? BMC Women’s Health, 22(1), 168. https://doi.org/10.1186/s12905-022-01750-w
7. Sola-Leyva, A., Andrés-León, E., Molina, N. M., Terron-Camero, L. C., Plaza-Díaz, J., Sáez-Lara, M. J., Gonzalvo, M. C., Sánchez, R., Ruíz, S., Martínez, L., & Altmäe, S. (2021). Mapping the entire functionally active endometrial microbiota. Human Reproduction, 36(4), 1021–1031. https://doi.org/10.1093/humrep/deaa372
8. Günther, V., Allahqoli, L., Watrowski, R., Maass, N., Ackermann, J., von Otte, S., & Alkatout, I. (2022). Vaginal Microbiome in Reproductive Medicine. Diagnostics, 12(8), 1948. https://doi.org/10.3390/diagnostics12081948
9. Vomstein, K., Reider, S., Böttcher, B., Watschinger, C., Kyvelidou, C., Tilg, H., Moschen, A. R., & Toth, B. (2022). Uterine microbiota plasticity during the menstrual cycle: Differences between healthy controls and patients with recurrent miscarriage or implantation failure. Journal of Reproductive Immunology, 151, 103634. https://doi.org/10.1016/j.jri.2022.103634
10. Graham, M. E., Herbert, W. G., Song, S. D., Raman, H. N., Zhu, J. E., Gonzalez, P. E., Walther-António, M. R. S., & Tetel, M. J. (2021). Gut and vaginal microbiomes on steroids: Implications for women’s health. Trends in Endocrinology and Metabolism: TEM, 32(8), 554–565. https://doi.org/10.1016/j.tem.2021.04.014
11. Moreno, I., Codoñer, F. M., Vilella, F., Valbuena, D., Martinez-Blanch, J. F., Jimenez-Almazán, J., Alonso, R., Alamá, P., Remohí, J., Pellicer, A., Ramon, D., & Simon, C. (2016). Evidence that the endometrial microbiota has an effect on implantation success or failure. American Journal of Obstetrics & Gynecology, 215(6), 684–703. https://doi.org/10.1016/j.ajog.2016.09.075
12. de Souza, S. V., Monteiro, P. B., de Moura, G. A., Santos, N. O., Fontanezi, C. T. B., Gomes, I. de A., & Teixeira, C. A. (2023). Vaginal microbioma and the presence of Lactobacillus spp. as interferences in female fertility: A review system. JBRA Assisted Reproduction, 27(3), 496–506. https://doi.org/10.5935/1518-0557.20230006
13. Landolt, E. F., da Conceição Mendonça, J., Behler, A. E., Lumsdaine, S. W., Jafar, T., & Burcham, L. R. (2025). Exploring the vaginal ecosystem: Insights into host-microbe interactions and microbial community dynamics. Infection and Immunity, 93(9), e00499-24. https://doi.org/10.1128/iai.00499-24
14. Xiao, L., Zuo, Z., & Zhao, F. (2023). Microbiome in Female Reproductive Health: Implications for Fertility and Assisted Reproductive Technologies. Genomics, Proteomics & Bioinformatics, 22(1), qzad005. https://doi.org/10.1093/gpbjnl/qzad005
15. Lorentzen, G. M., Łaniewski, P., Cui, H., Mahnert, N. D., Mourad, J., Borst, M. P., Willmott, L., Chase, D. M., Roe, D. J., & Herbst-Kralovetz, M. M. (2024). Cervicovaginal Metabolome and Tumor Characteristics for Endometrial Cancer Detection and Risk Stratification. Clinical Cancer Research: An Official Journal of the American Association for Cancer Research, 30(14), 3073–3087. https://doi.org/10.1158/1078-0432.CCR-23-2934
16. Abdalla, W., Ibrahim, W. N., Abdallah, A. M., Al-Asmakh, M. A., & Said, S. S. (2025). The role of the microbiome in endometrial carcinoma: Pathogenesis, biomarkers, and therapeutic prospects. Journal of Obstetrics and Gynaecology Research, 51(9), e70070. https://doi.org/10.1111/jog.70070