CNSH. Lê Thị Quỳnh – IVFMD SIH – Bệnh viện Phụ sản Quốc tế Sài Gòn
- Mở đầu
Thụ tinh trong ống nghiệm (TTTON) ra đời vào cuối thập niên 1970, sau đó phát triển mạnh mẽ vào giữa thập niên 2020 không chỉ là một chuỗi các cải tiến kỹ thuật mà còn là một sự thay đổi sâu sắc về tư tưởng trong điều trị. Trong giai đoạn đầu của công nghệ hỗ trợ sinh sản (HTSS), mục tiêu của bác sĩ và bệnh nhân là đạt được thai kỳ. Điều này dẫn đến việc sử dụng các phác đồ kích thích buồng trứng (KTBT) cường độ cao và chuyển nhiều phôi cùng lúc nhằm tối đa hóa cơ hội có thai trong một lần thực hiện[1].
Tuy nhiên, thực tế lâm sàng qua nhiều thập kỷ đã cho thấy những mặt trái của cách tiếp cận này. Những hệ quả về tỷ lệ đa thai cao (có lúc tới 30-40%), hội chứng quá kích buồng trứng (QKBT) và các biến chứng sản khoa nghiêm trọng đã thúc đẩy một hướng đi mới[1]. Thay vì chỉ tập trung vào việc có thai, xu hướng TTTON hiện đại hiện nay đặt mục tiêu "sinh ra một đứa trẻ khỏe mạnh, đủ tháng" lên hàng đầu, coi đó là thước đo chuẩn mực nhất cho sự thành công của một chu kỳ điều trị[2].
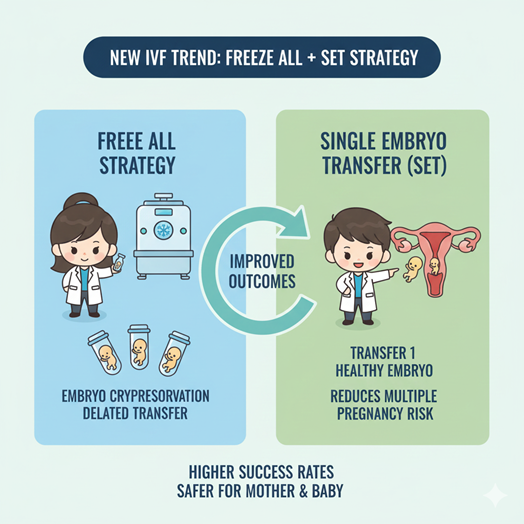
Xu hướng mới này được thực hiện với hai chiến lược chính: Trữ lạnh toàn bộ (Freeze-all) kết hợp chuyển đơn phôi có chọn lọc (Elective Single Embryo Transfere - eSET)[3], [4]. Trữ lạnh toàn bộ được định nghĩa là quy trình trữ đông toàn bộ phôi chất lượng tốt và trì hoãn việc chuyển phôi sang các chu kỳ sau. Phương pháp này cho phép cơ thể người phụ nữ hồi phục hoàn toàn khỏi các tác động của thuốc KTBT, giúp nội mạc tử cung (NMTC) trở về trạng thái sinh lý tự nhiên nhất trước khi đón nhận phôi đến làm tổ[5].
Song song với đó, eSET tập trung vào việc chỉ lựa chọn một phôi duy nhất có tiềm năng phát triển cao nhất để chuyển vào tử cung. Mục tiêu của eSET là loại bỏ nguy cơ đa thai - yếu tố làm tăng đáng kể các rủi ro như sinh non, nhẹ cân và tiền sản giật trong khi vẫn duy trì tỷ lệ trẻ sinh sống cộng dồn ở mức tối ưu nhờ vào sự tiến bộ của công nghệ nuôi cấy và sàng lọc phôi[4].
Sự kết hợp giữa Freeze-all và eSET không chỉ là một giải pháp kỹ thuật mà còn là một bước tiến mang tính nhân văn. Sự kết hợp này giúp tối ưu hóa khả năng làm tổ thông qua việc đồng bộ giữa phôi và NMTC, đồng thời giảm thiểu rủi ro cho cả người mẹ và thai nhi xuống mức thấp nhất[6].
- Chiến lược trữ lạnh toàn bộ
Trong một chu kỳ kinh nguyệt tự nhiên, sự chuẩn bị của NMTC được điều phối nhịp nhàng bởi các nồng độ hormone sinh lý. Tuy nhiên, trong TTTON, việc sử dụng các loại thuốc KTBT đẩy nồng độ Estradiol (E2) và Progesterone (P4) lên cao hơn mức sinh lý[7].
Dưới tác động của nồng độ hormone cao bất thường, sự phát triển của NMTC thường bị đẩy nhanh hơn so với sự phát triển của phôi. Hiện tượng P4 tăng sớm làm thay đổi biểu hiện gen của NMTC, khiến cửa sổ làm tổ đóng lại sớm hơn[7]. Khi phôi được đưa vào, NMTC có thể đã đi qua giai đoạn tiếp nhận tối ưu, dẫn đến thất bại làm tổ dù phôi có chất lượng tốt[8]. Chiến lược Freeze-all cho phép tách rời quá trình KTBT và quá trình chuẩn bị NMTC, tạo điều kiện cho phôi được chuyển vào một môi trường tử cung tối ưu nhất, không còn chịu ảnh hưởng của nồng độ hormone cao[3].
Việc áp dụng chiến lược Freeze-all mang lại những lợi ích lâm sàng vượt trội, trước hết là khả năng loại bỏ nguy cơ QKBT, một biến chứng đe dọa tính mạng thường gặp ở những bệnh nhân có dự trữ buồng trứng cao hoặc mắc hội chứng buồng trứng đa nang[5]. Bằng cách tách rời quá trình KTBT và làm tổ, Freeze-all giúp đưa nguy cơ QKBT về gần mức 0%, đảm bảo an toàn ở mức cao nhất cho người mẹ trong suốt quá trình điều trị. Đối với nhóm bệnh nhân đáp ứng cao với số lượng nang noãn >15, chiến lược này giúp tối ưu hóa tỷ lệ trẻ sinh sống thông qua việc tránh được các tác động tiêu cực của nồng độ nội tiết tố cao hơn mức sinh lý lên sự tiếp nhận của NMTC trong chu kỳ chuyển phôi tươi[3].
Ngoài yếu tố an toàn và hiệu quả làm tổ, Freeze-all còn đóng vai trò quan trọng cho việc thực hiện sàng lọc di truyền tiền làm tổ[9]. Phương pháp này cung cấp khoảng thời gian cần thiết để thực hiện các kỹ thuật sàng lọc gen phức tạp mà không làm giảm đi tiềm năng phát triển của phôi nang, giúp tăng tỷ lệ trẻ sinh sống và giảm nguy cơ sảy thai, đặc biệt ở phụ nữ lớn tuổi[9].
Bên cạnh đó, sự ra đời của phương pháp thủy tinh hóa là một bước ngoặt lớn của công nghệ HTSS. Đây là quy trình làm lạnh cực nhanh để đạt đến trạng thái "thủy tinh" mà không hình thành tinh thể đá gây tổn thương tế bào[10]. Tỷ lệ phôi sống sau rã đông hiện nay đạt mức gần như tuyệt đối, cho phép các bác sĩ tự tin hơn khi lựa chọn thực hiện Freeze-all[5].
- Chiến lược chuyển đơn phôi
Mục tiêu chính của chiến lược chuyển đơn phôi (Single Embryo Transfer- SET) là giảm tỷ lệ đa thai, vốn được coi là biến chứng lớn nhất của TTTON hiện đại[1].
Đa thai liên quan trực tiếp đến sự gia tăng tỷ lệ tiền sản giật, đái tháo đường thai kỳ và sinh non[1]. Dữ liệu từ nghiên cứu của Anja và cộng sự (2005) cho thấy eSET làm giảm đáng kể nguy cơ trẻ nhẹ cân (< 2.500g) so với việc chuyển hai phôi[2]. Nghiên cứu phân tích tổng hợp của McLernon và cộng sự (2010) cũng ủng hộ quan điểm này[4].
Bên cạnh đó, việc chuyển từng phôi một qua nhiều lần đã được chứng minh mang lại tỷ lệ trẻ sinh sống cộng dồn tương đương với chuyển nhiều phôi cùng lúc nhưng an toàn hơn rất nhiều[4].
- Xu hướng mới hướng tới phác đồ IVF tối ưu
Sự kết hợp giữa chiến lược Freeze-all và eSET tạo nên một chu kỳ điều trị lý tưởng, đặc biệt có ý nghĩa đối với nhóm bệnh nhân có dự trữ buồng trứng cao và nhóm bệnh nhân thất bại chuyển phôi tươi nhiều lần[6]. Đối với phụ nữ lớn tuổi, sự kết hợp này là bắt buộc để tích hợp xét nghiệm di truyền tiền làm tổ, cho phép lựa chọn chuyển một phôi nguyên bội có khả năng phát triển cao nhất, từ đó giảm thiểu số lần chuyển phôi không hiệu quả và nguy cơ sảy thai[11].
Mặc dù mang lại hiệu quả vượt trội, các chiến lược này vẫn đối mặt với những rào cản về tâm lý và kinh tế[4]. Việc trì hoãn chuyển phôi trong chiến lược Freeze-all có thể làm tăng mức độ lo âu và áp lực chờ đợi ở bệnh nhân do kéo dài thời gian có thai. Bên cạnh đó, chi phí lưu giữ và chuẩn bị NMTC cho các chu kỳ chuyển phôi trữ lạnh cũng là một gánh nặng tài chính cho bệnh nhân và gia đình[12].
Chính vì vậy, không nên áp dụng Freeze-all một cách đại trà cho mọi đối tượng. Đối với những bệnh nhân có đáp ứng buồng trứng bình thường hoặc nhóm tiên lượng kém, việc chuyển phôi tươi vẫn có thể là lựa chọn tối ưu để rút ngắn thời gian điều trị mà không làm giảm tỷ lệ sinh sống cộng dồn[13]. Quyết định lâm sàng cuối cùng luôn cần dựa trên sự đánh giá cá thể hóa, kết hợp giữa bằng chứng khoa học, điều kiện sức khỏe cụ thể và nguyện vọng của từng cặp vợ chồng.
- Kết luận
Chiến lược Freeze-all kết hợp với eSET là một bước tiến mới của công nghệ HTSS. Trong tương lai, việc chuyển đơn phôi kết hợp với các phương pháp sàng lọc không xâm lấn sẽ trở thành tiêu chuẩn mới, đảm bảo mục tiêu quan trọng nhất: một gia đình hạnh phúc với những đứa trẻ khỏe mạnh.
Tài liệu tham khảo:
[1] Van Rumste, M. M. E. (2013). Outcome measures in reproductive medicine trials [Doctoral dissertation, Universiteit van Amsterdam]. UvA-DARE (Digital Academic Repository). https://pure.uva.nl/ws/files/2091037/124848_thesis.pdf
[2] Pinborg, A. (2005). IVF/ICSI twin pregnancies: risks and prevention. Human Reproduction Update, 11(6), 575–593. https://doi.org/10.1093/humupd/dmi027
[3] Bourdon et al. (2021). The freeze-all strategy after IVF: which indications?. Reproductive biomedicine online, 42(3), 529-545.
[4] McLernon et al. (2010). Clinical effectiveness of elective single versus double embryo transfer: meta-analysis of individual patient data from randomised trials. Bmj, 341.
[5] Sadeghi, M. R. (2017). Freeze all Policy: An Expanded Strategy Before Its Clinical Approval. Journal of Reproduction & Infertility, 18(4), 341.
[6] Roque, M., & Esteves, S. C. (2020). Elective frozen embryo transfer (freeze-all): there seems to be no harm to transfer in the next immediate menstrual cycle. Annals of Translational Medicine, 8(15), 913.
[7] Dieamant et al. (2017). Fresh embryos versus freeze-all embryos-transfer strategies: nuances of a meta-analysis. JBRA Assisted Reproduction, 21(3), 260.
[8] Biliangady et al. (2019). Is it time to move toward freeze-all strategy?–A retrospective study comparing live birth rates between fresh and first frozen blastocyst transfer. Journal of Human Reproductive Sciences, 12(4), 321-326.
[9] Celada, P., & Bosch, E. (2020). Freeze-all, for whom, when, and how. Upsala journal of medical sciences, 125(2), 104-111.
[10] Sciorio et al. (2024). Vitrification of human blastocysts for couples undergoing assisted reproduction: an updated review. Frontiers in Cell and Developmental Biology, 12, 1398049.
[11] Pilegaard et al. (2023). Psychosocial wellbeing shortly after allocation to a freeze-all strategy compared with a fresh transfer strategy in women and men: a sub-study of a randomized controlled trial. Human Reproduction, 38(11), 2175-2186.
[12] Dierickx et al. (2023). Psychosocial wellbeing shortly after allocation to a freeze-all strategy compared with a fresh transfer strategy in women and men: A sub-study of a randomized controlled trial. Human Reproduction, 38(10), 1957–1967. https://doi.org/10.1093/humrep/dead174
[13] Stormlund et al. (2020). Freeze-all versus fresh blastocyst transfer strategy during in vitro fertilisation in women with regular menstrual cycles: multicentre randomised controlled trial. bmj, 370