ThS. Nguyễn Thị Ngọc Hân, ThS. BS. Trần Thị Ngọc Anh
Olea Fertility, Bệnh viện Quốc tế Vinmec Central Park
GIỚI THIỆU
Yếu tố nam giới chiếm khoảng 50% các trường hợp vô sinh, chủ yếu liên quan đến chất lượng tinh dịch kém. Việc đánh giá vô sinh nam thường bắt đầu với tinh dịch đồ để xác định bất thường trong các thông số gồm mật độ, di động và hình dạng tinh trùng. Tuy nhiên, hiện nay 30-40% nam giới bị vô sinh chưa rõ nguyên nhân dù các thông số tinh dịch đồ được đánh giá trong phạm vi “bình thường” cho thấy các kết quả của tinh dịch đồ chưa phản ánh đầy đủ tình trạng và chất lượng tinh trùng. Trong bối cảnh tìm kiếm các phương pháp đánh giá chính xác hơn, chiều dài telomere tinh trùng (Sperm Telomere Length – STL) đã trở thành một chủ đề nghiên cứu quan trọng được nhiều tác giả quan tâm trong lĩnh vực sinh sản nam giới.1 Bài viết này tóm tắt mối liên hệ giữa STL và sức khỏe ở nam giới.
TELOMERE TINH TRÙNG
Telomere là cấu trúc DNA-protein được tạo thành từ các chuỗi lặp lại 5'-TTAGGG-3' ở đầu mút của nhiễm sắc thể, đóng vai trò quan trọng trong việc bảo vệ nhiễm sắc thể khỏi sự phân hủy và duy trì tính toàn vẹn của bộ gen. Telomere ngăn ngừa sự rút ngắn của bộ gen bằng cách bao phủ đầu mút của sợi DNA và giảm thiểu tác động từ quá trình sao chép không hoàn chỉnh của DNA polymerase.2 Tuy nhiên, qua mỗi lần phân bào, telomere bị rút ngắn dần, kích hoạt phản ứng tổn thương DNA. Khi bị rút ngắn đến một mức độ nhất định, tế bào sẽ trải qua quá trình lão hóa hoặc apoptosis.3,4
Quá trình sinh tinh diễn ra suốt đời, và nếu sự phân chia tế bào không có cơ chế kéo dài telomere, sẽ dẫn đến tình trạng apoptosis. Do đó, các tế bào sinh tinh có khả năng duy trì telomere dựa vào hoạt động của telomerase, một phức hợp ribonucleoprotein gồm telomerase reverse transcriptase (TERT) và telomerase RNA (TERC). Phức hợp này hoạt động bằng cách bổ sung đoạn trình tự lặp lại 5’-TTAGGG-3’ vào đầu mút nhiễm sắc thể hoặc thông qua cơ chế tái tổ hợp tương đồng, giúp duy trì các tế bào sinh tinh.1,5
STL và hoạt động của telomerase thay đổi theo từng giai đoạn của quá trình sinh tinh. Chúng phát triển mạnh từ giai đoạn tế bào gốc sinh tinh (spermatogonia) đến tinh bào sơ cấp (primary spermatocytes). Ở những giai đoạn sau, do hoạt động của telomerase giảm đáng kể, quá trình kéo dài telomere không còn đủ để bù đắp sự rút ngắn xảy ra do quá trình xử lý telomere hoặc tổn thương oxy hóa.6,7
MỐI LIÊN QUAN GIỮA CHIỀU DÀI TELOMERE TINH TRÙNG VÀ SỨC KHỎE SINH SẢN Ở NAM GIỚI
Mối liên quan giữa chiều dài telomere tinh trùng và chất lượng tinh trùng
Các nghiên cứu gần đây đã đề xuất sử dụng STL như một chỉ số tiềm năng trong đánh giá vô sinh nam, đồng thời phản ánh mối liên hệ giữa STL với các thông số tinh dịch đồ. Một phân tích tổng hợp của Fernandez và cộng sự4 (2024) cho thấy STL ngắn hơn đáng kể ở nhóm vô sinh so với nhóm có khả năng sinh sản, với chênh lệch trung bình là –1,43 (Khoảng tin cậy 95%: –1,66 đến –1,21; p < 0,001). Sự khác biệt này cũng có ý nghĩa thống kê khi so sánh nhóm có tinh dịch đồ bình thường và nhóm có mật độ tinh trùng thấp (p < 0,001).
Ngoài các thông số tinh dịch đồ tiêu chuẩn, mối liên hệ giữa STL với tình trạng phân mảnh DNA và quá trình protamine hóa cũng đã được nhiều nghiên cứu chứng minh. Các gốc oxy hóa (Reactive Oxygen Species – ROS) là tác nhân chính gây đứt gãy DNA tinh trùng, và do telomere chứa hàm lượng guanin cao, chúng dễ bị tổn thương hơn so với các vùng DNA không thuộc telomere. Khi telomere bị rối loạn chức năng, chúng có thể trở thành mục tiêu của ROS, làm gia tăng tỷ lệ tinh trùng có DNA bị phân mảnh và gây mất các trình tự telomere. Bên cạnh đó, sự đóng gói DNA kém có thể làm telomere trong tinh trùng trưởng thành bị gián đoạn do tiếp xúc nhiều hơn với ROS. Do đó, rối loạn điều hòa telomere trong tinh trùng trưởng thành có thể bắt nguồn từ khiếm khuyết trong quá trình cô đặc nhiễm sắc thể.8
Nghiên cứu của Rocca và cộng sự9 (2016) cho thấy STL có mối liên hệ nghịch với sự phân mảnh DNA tinh trùng (p = 0,001), trong khi có mối liên hệ thuận đáng kể với quá trình protamine hóa (p = 0,002). Việc hiểu rõ sự liên kết giữa STL, sự phân mảnh DNA tinh trùng và quá trình protamine hóa sẽ góp phần làm sáng tỏ những cơ chế sinh lý bệnh học quan trọng liên quan đến chất lượng tinh trùng và khả năng sinh sản ở nam giới. Phân tích STL có thể là một công cụ bổ trợ hữu ích bên cạnh tinh dịch đồ trong những trường hợp vô sinh nam chưa rõ nguyên nhân.1 Tuy nhiên, hiện nay vẫn còn nhiều tranh cãi về việc sử dụng STL như một chỉ số bổ sung trong đánh giá vô sinh nam.1 Vì vậy, cần có thêm các nghiên cứu quy mô lớn, chuẩn hóa phương pháp đo STL nhằm xác định chính xác vai trò của STL trong chẩn đoán và điều trị vô sinh nam.
Mối liên quan giữa chiều dài telomere tinh trùng và khả năng mang thai
Nhiều nghiên cứu đã đánh giá tác động của STL đối với khả năng sinh sản tự nhiên và hiệu quả của IVF. Một nghiên cứu của Yang và cộng sự10 (2015) khi phân tích mẫu tinh trùng từ 418 cặp vợ chồng hiếm muộn trong chu kỳ IVF đầu tiên đã phát hiện mối tương quan tích cực giữa STL và chất lượng phôi. Kết quả ở Bảng 1 cho thấy STL có ảnh hưởng đáng kể đến tỷ lệ phôi chất lượng tốt (hệ số dương 1,63; P < 0,001), nghĩa là STL càng dài, tỷ lệ phôi chất lượng tốt càng cao.9
Phân tích tổng hợp gần đây của Yuan và cộng sự5 (2022), dựa trên dữ liệu từ 4 nghiên cứu tiến cứu với 1.386 người tham gia, chỉ ra rằng nhóm có STL dài có tỷ lệ mang thai lâm sàng cao hơn 13% so với nhóm STL ngắn (p < 0,05). Tuy nhiên, từ số liệu ghi nhận trên 9.144 người thực hiện hỗ trợ sinh sản (ICSI và IVF), không có sự khác biệt đáng kể về tỷ lệ thụ tinh giữa hai nhóm STL dài và ngắn (p = 0,08).
Bảng 1. Hồi quy tỷ lệ phôi chất lượng tốt dựa trên STL và các yếu tố liên quan
|
Mô hình |
Biến độc lập |
Hệ số hồi quy |
95% CI của hệ số hồi quy |
P# |
|
|
Hằng số |
80,22 |
42,69 đến 117,76 |
<0,001 |
|
|
STL |
1,63 |
0,89 đến 2,37 |
<0,001 |
|
|
Tuổi nữ |
−0,26 |
−1,14 đến 0,63 |
0,57 |
|
|
Tuổi nam |
−0,68 |
−1,59 đến 0,23 |
0,14 |
|
|
BMI nữ |
−0,11 |
−0,87 đến 0,65 |
0,77 |
|
|
BMI nam |
0,26 |
−0,11 đến 1,59 |
0,70 |
|
|
FSH |
−1,22 |
−2,76 đến 0,33 |
0,12 |
|
|
Số lượng tinh trùng |
0,01 |
0,00 đến 0,03 |
0,03 |
Tỷ lệ phôi chất lượng tốt: (số lượng phôi loại 1 và 2 / tổng số phôi 2PN) × 100%. #t-test Nguồn: Yang và cộng sự10 (2015).
Mối liên quan giữa chiều dài telomere tinh trùng của cha và sức khỏe trẻ sinh ra
Nhiều nghiên cứu cho thấy STL dài có thể giúp giảm nguy cơ mắc một số bệnh ở trẻ sinh ra, bao gồm rối loạn phát triển thần kinh và các bệnh chuyển hóa.11,12 Con cái của những người cha lớn tuổi thường có chiều dài telomere dài hơn qua các thế hệ, điều này được cho là có liên quan đến sự chọn lọc tinh trùng với STL dài, giúp loại bỏ những tế bào gốc có telomere ngắn qua quá trình suy giảm tế bào theo thời gian.1
Mặc dù STL dài ở thế hệ con cháu có thể làm giảm nguy cơ xơ vữa động mạch, nhưng nó cũng có thể làm tăng nguy cơ mắc một số loại ung thư trong giai đoạn đầu đời.11 Theo báo cáo của Arbeev và cộng sự13 (2011), các cô con gái của những người cha lớn tuổi thường có nguy cơ cao mắc ung thư vú.
CÁC YẾU TỐ ẢNH HƯỞNG VÀ PHƯƠNG PHÁP CẢI THIỆN STL
Các yếu tố ảnh hưởng tích cực đến STL
STL bị ảnh hưởng bởi nhiều yếu tố sinh học và môi trường, được minh họa trong Hình 1.1 Khác với hầu hết các tế bào sinh dưỡng, nhiều bằng chứng cho thấy STL có xu hướng tăng lên theo thời gian. Một số ý kiến cho rằng, mức độ telomerase cao trong tinh hoàn góp phần làm STL tăng theo tuổi tác. Ngoài ra, quá trình loại bỏ các tế bào gốc tinh trùng với STL ngắn và giữ lại các tế bào gốc tinh trùng có STL dài cũng là một nguyên nhân khiến STL ở những người nam lớn tuổi thường dài hơn.14
Ngoài các yếu tố sinh học, phơi nhiễm với các độc tố môi trường như dioxins và polychlorinated biphenyls lại có liên quan đến việc gia tăng STL. Tuy nhiên, trong trường hợp này, STL dài không mang lại lợi ích sinh học mà ngược lại có thể làm tăng nguy cơ tích lũy đột biến và thúc đẩy quá trình hình thành khối u, dẫn đến ung thư.15
Các yếu tố ảnh hưởng tiêu cực đến STL
Ngược lại, các yếu tố môi trường như ô nhiễm không khí, carbon monoxide và PM2.5 đã được chứng minh có tác động tiêu cực đến STL.15,16 Nghiên cứu trên mô hình động vật cho thấy STL ngắn hơn khi phơi nhiễm các tác nhân hóa trị như bleomycin, etoposide, cyclophosphamide, và cisplatin.17
Lối sống thụ động, hút thuốc lá và béo phì cũng ảnh hưởng tiêu cực đến chức năng telomere, làm gia tăng stress oxy hóa và tổn thương DNA tinh trùng.1,3 Hút thuốc lá không chỉ làm suy giảm thể tích, mật độ, khả năng di chuyển, tỷ lệ sống và hình thái tinh trùng mà còn gây tổn thương DNA, rối loạn số lượng nhiễm sắc thể và đột biến tinh trùng. Các độc tố từ khói thuốc làm tăng stress oxy hóa do sự tích lũy ROS và suy giảm enzyme chống oxy hóa trong bào tương tinh trùng. Tương tự, béo phì làm tăng phân mảnh DNA tinh trùng, tỷ lệ tinh trùng có chromatin chưa trưởng thành và mức ROS nội bào, đồng thời thúc đẩy quá trình apoptosis, làm giảm tỷ lệ sống của tinh trùng. 18
Việc hiểu rõ những tác động này không chỉ giúp nâng cao nhận thức mà còn mở ra hướng đi tiềm năng cho các biện pháp phòng ngừa và cải thiện chiều dài telomere tinh trùng (STL).1
Phương pháp cải thiện STL
Sử dụng các chất chống oxy hóa chứa các thành phần như vitamin B12, kẽm, selenium, arginine, và các vitamin khác là phương pháp phổ biến để cải thiện chất lượng tinh trùng. Theo Agarwal và cộng sự19 (2019), chất chống oxy hóa kích hoạt hoạt động của phức hợp protein chaperone, tailess complex polypeptide 1 ring (TRiC), giúp hỗ trợ quá trình nén nhân, duy trì chiều dài telomere và chức năng của đuôi tinh trùng, từ đó cải thiện chất lượng tinh trùng và duy trì STL. Phân tích in silico cũng cho thấy liệu pháp chống oxy hóa có tác động tích cực đến một số yếu tố phiên mã quan trọng như CCNE1, H2AX, MYC, RB1, và TP53, liên quan đến sự duy trì telomere tinh trùng. Trong đó, CCNE1 chịu trách nhiệm chính trong việc duy trì telomere, còn sự thiếu hụt H2AX có liên quan đến tính không ổn định của bộ gen. Đồng thời, MYC điều chỉnh telomerase, đặc biệt là c-MYC tương tác với proteinase inhibitor 2 (TRF1/PIN2), giúp kéo dài các đoạn lặp telomere. Ngoài ra, các con đường tín hiệu EGFR tham gia điều hòa STL bằng cách ức chế hoạt động của telomerase, trong khi con đường MAPK3/ ERK2 điều hòa TRF-2 để duy trì tính ổn định của telomere trong tế bào. Nhờ vậy, liệu pháp chống oxy hóa góp phần kiểm soát tình trạng vô sinh ở nam giới.18
Về lối sống, chế độ ăn uống lành mạnh và hoạt động thể chất là những phương pháp hữu ích giúp cải thiện chất lượng tinh trùng, bao gồm STL.1 Tuy nhiên, nhiều chuyên gia khuyến cáo rằng chỉ khi duy trì tập thể dục đều đặn với cường độ vừa phải, cơ thể mới có thể cân bằng hệ thống oxy hóa/chống oxy hóa trong tinh dịch, từ đó góp phần cải thiện chất lượng tinh trùng.20
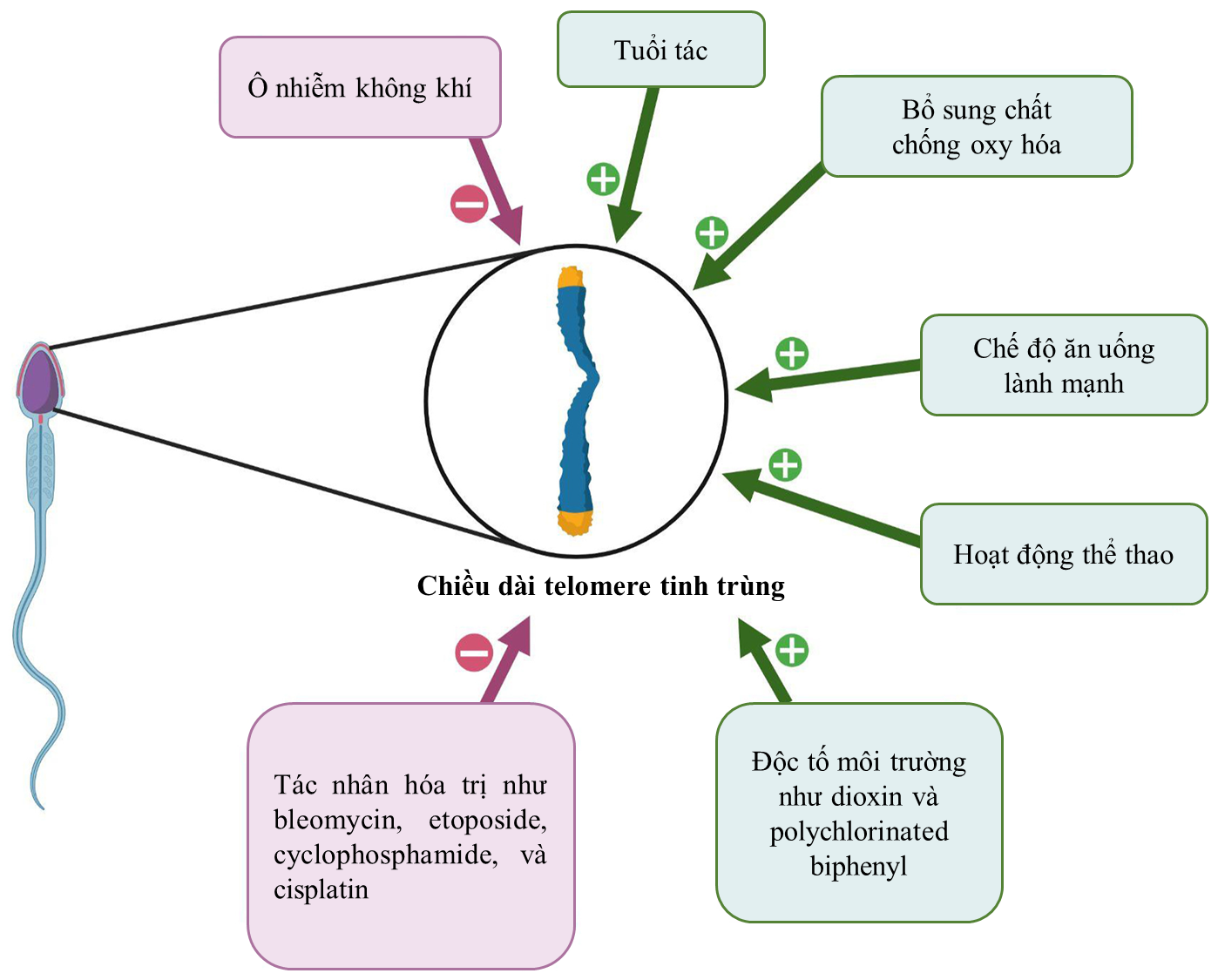 Hình 1. Các yếu tố tác động đến chiều dài telomere tinh trùng.
Hình 1. Các yếu tố tác động đến chiều dài telomere tinh trùng.
Nguồn: Randell và cộng sự1 (2024).
Vì STL giúp dự đoán chất lượng phôi, tỷ lệ làm tổ thành công và tỷ lệ thai lâm sàng trong quá trình điều trị IVF4,7, nó có thể là một tiêu chí quan trọng trong việc lựa chọn tinh trùng. Hiện nay, hai phương pháp phổ biến để chọn lọc tinh trùng chất lượng tốt là thang nồng độ (density gradient centrifugation) và bơi lên (swim-up). Cả hai phương pháp đều giúp thu nhận tinh trùng có STL dài hơn, khả năng di động tiến tới cao hơn và mức độ phân mảnh DNA thấp hơn, với sự khác biệt không đáng kể giữa chúng.Tuy nhiên, cần có thêm nghiên cứu để so sánh hiệu quả chọn lọc giữa hai phương pháp, nhằm tối ưu hóa quy trình lựa chọn tinh trùng cho hỗ trợ sinh sản.
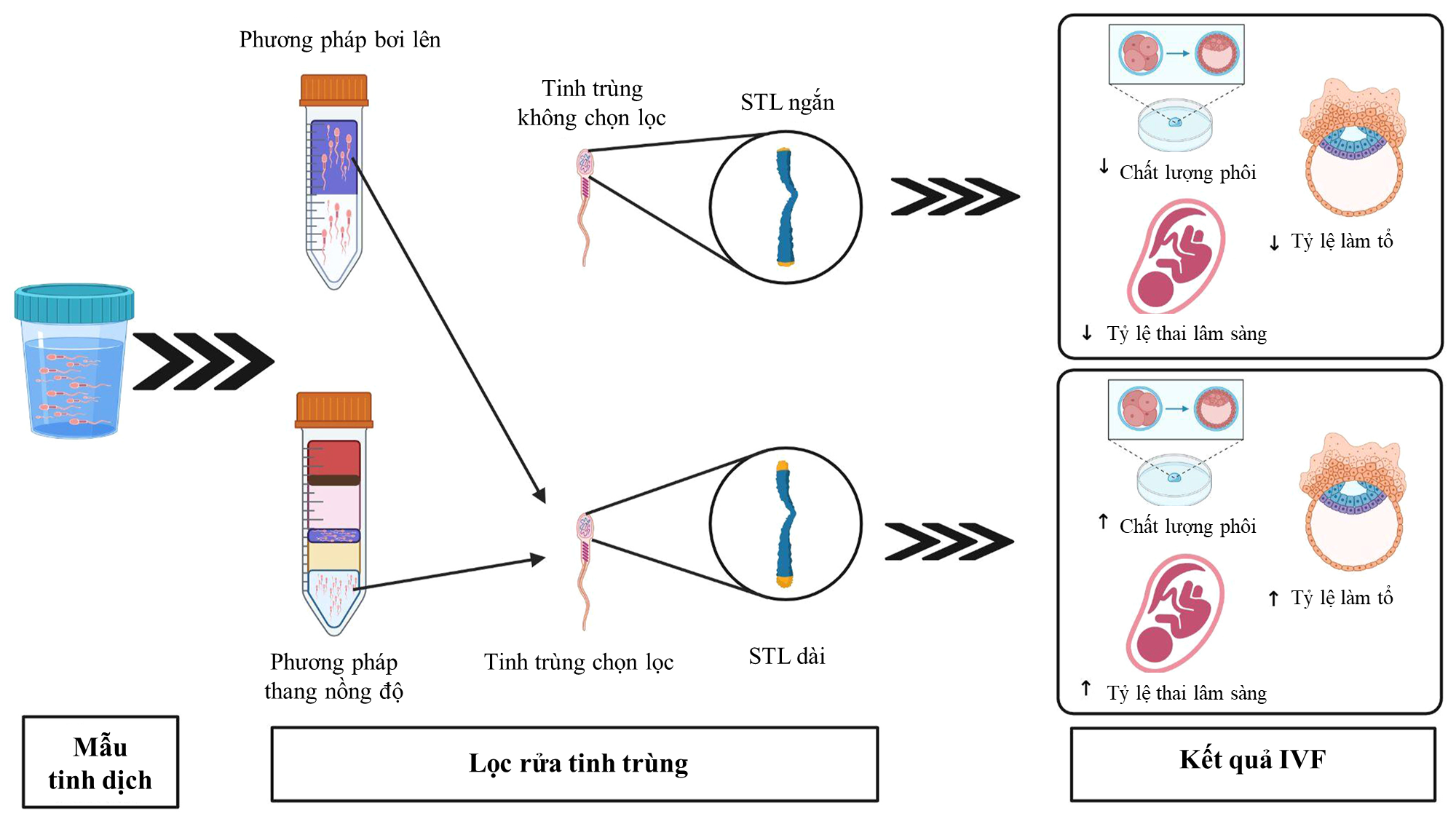
Hình 2. Tác động của việc chọn lọc tinh trùng STL dài thông qua kỹ thuật bơi lên hoặc thang nồng độ đến kết quả IVF.
Nguồn: Randell và cộng sự1 (2024).
KẾT LUẬN
Chiều dài telomere tinh trùng (STL) đóng vai trò quan trọng trong việc bảo vệ nhiễm sắc thể, duy trì tính toàn vẹn của bộ gen tinh trùng. STL có mối liên hệ tích cực với các thông số tinh dịch đồ, chất lượng phôi, kết quả thai lâm sàng và sức khỏe của trẻ sinh ra. Vì vậy, STL được xem là một yếu tố dự đoán quan trọng trong đánh giá và chẩn đoán vô sinh nam. Nghiên cứu về STL không chỉ giúp hiểu rõ hơn về cơ chế lão hóa tế bào mà còn làm sáng tỏ tác động của các yếu tố môi trường và lối sống đối với khả năng sinh sản ở nam giới.
Việc áp dụng các phương pháp chọn lọc tinh trùng dựa trên STL có thể mang lại những đột phá đáng kể trong việc tối ưu hóa kết quả điều trị IVF. Trong tương lai, các nghiên cứu chuyên sâu về cơ chế điều hòa STL (bao gồm yếu tố di truyền và môi trường), tác động lâm sàng của STL, cũng như những can thiệp nhằm cải thiện STL, hứa hẹn sẽ mang lại những đóng góp quan trọng trong việc nâng cao hiệu quả điều trị hiếm muộn và cải thiện sức khỏe sinh sản toàn diện.
TÀI LIỆU THAM KHẢO
1. Randell Z, Dehghanbanadaki H, Fendereski K, Jimbo M, Aston K, Hotaling J. Sperm telomere length in male-factor infertility and reproduction. Fertil Steril. 2024;121(1):12-25. doi:10.1016/j.fertnstert.2023.11.001
2. Fice HE, Robaire B. Telomere Dynamics Throughout Spermatogenesis. Genes. 2019;10(7):525. doi:10.3390/genes10070525
3. Shammas MA. Telomeres, lifestyle, cancer, and aging. Curr Opin Clin Nutr Metab Care. 2011;14(1):28-34. doi:10.1097/MCO.0b013e32834121b1
4. Fernández de la Puente M, Salas-Huetos A, Valle-Hita C, et al. Is telomere length a biomarker of sperm quality? A systematic review and meta-analysis of observational studies. Andrology. 2024;12(2):277-288. doi:10.1111/andr.13482
5. Yuan Y, Tan Y, Qiu X, et al. Sperm telomere length as a novel biomarker of male infertility and embryonic development: A systematic review and meta-analysis. Front Endocrinol. 2022;13:1079966. doi:10.3389/fendo.2022.1079966
6. Jørgensen PB, Fedder J, Koelvraa S, Graakjaer J. Age-dependence of relative telomere length profiles during spermatogenesis in man. Maturitas. 2013;75(4):380-385. doi:10.1016/j.maturitas.2013.05.001
7. Reig-Viader R, Capilla L, Vila-Cejudo M, et al. Telomere homeostasis is compromised in spermatocytes from patients with idiopathic infertility. Fertil Steril. 2014;102(3):728-738.e1. doi:10.1016/j.fertnstert.2014.06.005
8. Moustakli E, Zikopoulos A, Sakaloglou P, Bouba I, Sofikitis N, Georgiou I. Functional association between telomeres, oxidation and mitochondria. Front Reprod Health. 2023;5:1107215. doi:10.3389/frph.2023.1107215
9. Rocca MS, Speltra E, Menegazzo M, Garolla A, Foresta C, Ferlin A. Sperm telomere length as a parameter of sperm quality in normozoospermic men. Hum Reprod Oxf Engl. 2016;31(6):1158-1163. doi:10.1093/humrep/dew061
10. Yang Q, Zhao F, Dai S, et al. Sperm telomere length is positively associated with the quality of early embryonic development. Hum Reprod Oxf Engl. 2015;30(8):1876-1881. doi:10.1093/humrep/dev144
11. Aviv A, Susser E. Leukocyte telomere length and the father’s age enigma: implications for population health and for life course. Int J Epidemiol. 2013;42(2):457-462. doi:10.1093/ije/dys236
12. Pham C, Vryer R, O’Hely M, et al. Shortened Infant Telomere Length Is Associated with Attention Deficit/Hyperactivity Disorder Symptoms in Children at Age Two Years: A Birth Cohort Study. Int J Mol Sci. 2022;23(9):4601. doi:10.3390/ijms23094601
13. Arbeev KG, Hunt SC, Kimura M, Aviv A, Yashin AI. Leukocyte telomere length, breast cancer risk in the offspring: the relations with father’s age at birth. Mech Ageing Dev. 2011;132(4):149-153. doi:10.1016/j.mad.2011.02.004
14. Eisenberg DTA, Kuzawa CW. The paternal age at conception effect on offspring telomere length: mechanistic, comparative and adaptive perspectives. Philos Trans R Soc Lond B Biol Sci. 2018;373(1741):20160442. doi:10.1098/rstb.2016.0442
15. Vecoli C, Montano L, Borghini A, et al. Effects of Highly Polluted Environment on Sperm Telomere Length: A Pilot Study. Int J Mol Sci. 2017;18(8):1703. doi:10.3390/ijms18081703
16. Zhou L, Li L, Hao G, et al. Sperm mtDNA copy number, telomere length, and seminal spermatogenic cells in relation to ambient air pollution: Results of a cross-sectional study in Jing-Jin-Ji region of China. J Hazard Mater. 2021;406:124308. doi:10.1016/j.jhazmat.2020.124308
17. Liu M, Hales BF, Robaire B. Effects of four chemotherapeutic agents, bleomycin, etoposide, cisplatin, and cyclophosphamide, on DNA damage and telomeres in a mouse spermatogonial cell line. Biol Reprod. 2014;90(4):72. doi:10.1095/biolreprod.114.117754
18. Panner Selvam MK, Baskaran S, Sikka SC. Telomere Signaling and Maintenance Pathways in Spermatozoa of Infertile Men Treated With Antioxidants: An in silico Approach Using Bioinformatic Analysis. Front Cell Dev Biol. 2021;9:768510. doi:10.3389/fcell.2021.768510
19. Agarwal A, Panner Selvam MK, Samanta L, et al. Effect of Antioxidant Supplementation on the Sperm Proteome of Idiopathic Infertile Men. Antioxid Basel Switz. 2019;8(10):488. doi:10.3390/antiox8100488
20. Sharqawi M, Hantisteanu S, Bilgory A, et al. The Impact of Lifestyle on Sperm Function, Telomere Length, and IVF Outcomes. Am J Mens Health. 2022;16(5):15579883221119931. doi:10.1177/15579883221119931